SUNITINIB-AZR 12,5 mg kemény kapszula
Hatóanyag:
sunitinib
Csak vényre kapható
Kiszerelés:
28x1 adagonként perforált buborékcsomagolásban opa/al/pe//al lehúzható

Tájékoztató ár:
-
Normatív TB-támogatás:
Nem
Eü. emelt támogatás:
Nem
-
Gyógyszerfőkategória:
PROTEIN KINÁZ GÁTLÓK
-
Törzskönyvi szám:
OGYI-T-23892/02
-
Gyógyszeralkategória:
Egyéb protein-kináz gátlók
-
Gyártó:
HCM Pharma
Betegtájékoztató
1. Milyen típusú gyógyszer a Sunitinib-AZR és milyen betegségek esetén alkalmazható?
A Sunitinib-AZR hatóanyaga a szunitinib, amely egy proteinkináz-gátló. Daganatos betegség kezelésére alkalmazzák, ugyanis megakadályozza a rákos sejtek növekedésében és szóródásában résztvevő speciális fehérjék egy csoportjának működését.
A Sunitinib-AZR készítményt az alábbi típusú daganatos betegségekben szenvedő felnőttek kezelésére alkalmazzák:
- Emésztőrendszeri (gasztrointesztinális) sztróma tumor (GIST) - a gyomor és a bélrendszer daganatos betegségeinek egyik típusa -, olyan eseteiben, amikor az imatinib (egy másik daganatellenes gyógyszer) már nem hat vagy Ön nem szedhet imatinibet.
- Áttétet adó vesesejtes karcinóma (angol betűszóval: MRCC), a vesedaganatok egy fajtája, ami a test más részeibe is szétterjedt.
- A hasnyálmirigy neuroendokrin daganatai (angol betűszóval: pNET) (a hasnyálmirigy hormontermelő sejtjeinek daganatai), amik előrehaladottak vagy műtéti úton nem távolítható el.
Ha szeretné tudni, hogy hogyan hat a Sunitinib-AZR, vagy miért ezt a gyógyszert írták fel Önnek, kérdezze meg kezelőorvosát!
2. Tudnivalók a Sunitinib-AZR szedése előtt
Ne szedje a Sunitinib-AZR készítményt:
- ha allergiás a szunitinibre vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
Figyelmeztetések és óvintézkedések
A Sunitinib-AZR szedése előtt beszéljen kezelőorvosával:
- Ha magas a vérnyomása. A Sunitinib-AZR megemelheti a vérnyomást. Kezelőorvosa a Sunitinib-AZR-kezelés alatt ellenőrizheti a vérnyomását, és ha szükséges, vérnyomáscsökkentő gyógyszerekkel kezelheti Önt.
- Ha vérképzőszervi betegsége, vérzéses problémái vagy véraláfutásai vannak vagy voltak. A Sunitinib-AZR-kezelés megnövelheti a vérzés kockázatát vagy bizonyos vérsejtek számának változását okozhatja, ami vérszegénységhez vezethet, vagy befolyásolhatja vérének alvadási képességét. Ha warfarint vagy acenokumarolt szed (gyógyszerek, melyek megakadályozzák a vér alvadását), a vérzés kockázata magasabb lehet. Mondja el kezelőorvosának, ha a Sunitinib-AZR-kezelés alatt bármilyen vérzése jelentkezik.
- Ha szívproblémái vannak. A Sunitinib-AZR szívproblémákat okozhat. Mondja el kezelőorvosának, ha nagyon fáradtnak érzi magát, légszomja van, vagy lába és bokája megdagadt.
- Ha szívritmuszavarai vannak. A Sunitinib-AZR szívritmuszavart okozhat. Kezelőorvosa elektrokardiogram (EKG) vizsgálatot végezhet a Sunitinib-AZR-kezelés során, hogy kivizsgálja ezeket a problémákat. Mondja el kezelőorvosának, ha a Sunitinib-AZR-kezelés során szédül, elájul vagy a normálistól eltérő a szívverése.
- Ha nemrégiben a visszereiben és/vagy verőereiben (a vérerek típusai) vérrögképződéssel kapcsolatos problémái voltak, beleértve az agyi érkatasztrófát (sztrók), szívrohamot, embóliát vagy trombózist. Azonnal keresse fel kezelőorvosát, ha a Sunitinib-AZR-kezelés során olyan tüneteket észlel, mint például a mellkasi fájdalom vagy szorító érzés, fájdalom a karjában, hátában, vállában vagy állkapcsában, légszomj, zsibbadás vagy gyengeség testének egyik oldalán, a beszéd nehezítettsége, fejfájás vagy szédülés.
- Ha aneurizmája (az érfal kiboltosulása és meggyengülése) vagy érfalrepedése van vagy volt.
- Ha a legkisebb vérerek károsodásával járó, trombotikus mikroangiopátia (TMA) nevű betegsége volt vagy van. Mondja el kezelőorvosának, ha láz, kimerültség, fáradtság, véraláfutás, vérzés, duzzanat, zavartság, látásvesztés vagy görcsrohamok alakulnak ki Önnél.
- Ha pajzsmirigyproblémái vannak. A Sunitinib-AZR pajzsmirigyproblémákat okozhat. Mondja el kezelőorvosának, ha a Sunitinib-AZR szedése során könnyebben elfárad, jobban fázik, mint általában a többi ember, vagy hangja mélyebbé válik. Pajzsmirigye működését ellenőrizni kell a Sunitinib-AZR-kezelés előtt, valamint a kezelés során rendszeresen. Ha a pajzsmirigye nem termel elegendő pajzsmirigyhormont, pajzsmirigyhormon-pótló kezelésben részesülhet.
- Ha hasnyálmirigy- vagy epehólyagproblémái vannak. Mondja el kezelőorvosának, ha az alábbi jelek és tünetek közül bármelyik jelentkezik Önnél: gyomortáji fájdalom, hányinger, hányás és láz. Ezeket okozhatja a hasnyálmirigy vagy az epehólyag gyulladása.
- Ha májproblémái voltak vagy vannak. Mondja el kezelőorvosának, ha az alábbi jelek és tünetek közül bármelyik jelentkezik Önnél a Sunitinib-AZR-kezelés során: viszketés, a szemek vagy bőr sárgasága, sötét színű vizelet, valamint fájdalom vagy kellemetlen érzés a has jobb felső részében. A máj megfelelő működésének ellenőrzése érdekében kezelőorvosának vérvizsgálatokat kell végeznie a Sunitinib-AZR-kezelés megkezdése előtt, a kezelés alatt, illetve amikor azt az Ön állapota szükségessé teszi.
- Ha veseproblémái voltak vagy vannak. Kezelőorvosa figyelni fogja az Ön veseműködését.
- Ha műteni fogják, vagy nemrégiben műtéten esett át. A Sunitinib-AZR befolyásolhatja a sebgyógyulást. A műtét előtt valószínűleg le fogják állítani Önnél a Sunitinib-AZR alkalmazását. Kezelőorvosa dönti el, hogy mikor kezdje el újra szedni a Sunitinib-AZR készítményt.
- Mielőtt elkezdi a Sunitinib-AZR-kezelést, javasolhatják Önnek, hogy vegyen részt fogászati vizsgálaton.
-- Ha jelenleg tapasztalja vagy korábban tapasztalta a következő tüneteket, azonnal mondja el kezelőorvosának vagy fogorvosának: száj-, fog- és/vagy állkapocsfájdalom, duzzanat vagy afta a szájüregben, az állkapocs zsibbadása vagy elnehezülése, fog meglazulása.
-- Ha nagyobb beavatkozással járó, úgynevezett invazív fogászati kezelésen vagy szájsebészeti műtéten kell átesnie, mondja el fogorvosának, hogy Önt Sunitinib-AZR készítménnyel kezelik, különösen, ha biszfoszfonátot is kap vagy kapott intravénásan. A biszfoszfonátot lehet, hogy egy másik betegségének a csontrendszert érintő szövődményeinek megelőzésére kapja vagy kapta.
- Ha a bőr és a bőr alatti szövet betegségeiben szenvedett vagy szenved. Mialatt Ön ezt a gyógyszert szedi, előfordulhat a bőr fájdalmas kifekélyesedése (pioderma gangrenózum) vagy a bőr, illetve a lágyrészek gyorsan terjedő, akár életveszélyes fertőzése (nekrotizáló faszciitisz). Azonnal keresse fel kezelőorvosát, ha egy bőrsérülés területén fertőzés tünetei alakulnak ki, beleértve a lázat, fájdalmat, bőrpírt, duzzanatot vagy gennyes vagy véres váladékozást is. Ez általában visszafordítható a szunitinib abbahagyása után. A szunitinib alkalmazása során beszámoltak súlyos bőrkiütésről (Stevens-Johnson-szindróma, toxikus epidermális nekrolízis, eritéma multiforme), amely a törzsön eleinte vöröses, céltáblaszerű pontként vagy kör alakú foltként jelenik meg, középpontjában gyakran hólyagokkal. A kiütés annyira rosszabbodhat, hogy a bőr kiterjedt felhólyagosodásához vagy leválásához vezethet, és életveszélyessé válhat. Ha Önnél bőrkiütés vagy az előbbi bőrtünetek valamelyike alakul ki, azonnal kérjen orvosi segítséget.
- Ha görcsrohamai voltak vagy vannak. Értesítse kezelőorvosát, amilyen hamar csak lehet, ha magas a vérnyomása, fáj a feje vagy elveszti látását.
- Ha Ön cukorbeteg. A cukorbetegek vércukorszintjét rendszeresen ellenőrizni kell annak megállapítására, hogy az alacsony vércukorszint kockázatának minimalizálása érdekében szükséges-e módosítani a cukorbetegség elleni gyógyszer adagolását. Amilyen hamar csak lehet, értesítse kezelőorvosát, ha az alacsony vércukorszint okozta bármilyen jelet vagy tünetet észlel (fáradtság, szívdobogásérzés, izzadás, éhség és tudatvesztés).
Gyermekek és serdülők
A Sunitinib-AZR nem javasolt 18 évesnél fiatalabb betegek számára.
Egyéb gyógyszerek és a Sunitinib-AZR
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről.
Néhány gyógyszer befolyásolhatja a szunitinib szintjét a szervezetben. Tájékoztassa kezelőorvosát, ha a következő hatóanyagtartalmú gyógyszereket szedi:
ketokonazol, itrakonazol - gombafertőzések kezelésére használják;
eritromicin, klaritromicin, rifampicin - fertőzések kezelésére használják;
ritonavir - HIV- (emberi immunhiány vírus) fertőzés kezelésére használják;
dexametazon - egy kortikoszteroid, amelyet különböző betegségek (mint például allergiás/légzőszervi vagy bőrbetegségek) kezelésére használnak;
fenitoin, karbamazepin, fenobarbitál - epilepszia és egyéb ideggyógyászati betegségek kezelésére használják;
közönséges orbáncfüvet (Hypericum perforatum) tartalmazó gyógynövénykészítmények - depresszió és szorongás kezelésére használják.
A Sunitinib-AZR egyidejű bevétele étellel és itallal
A grépfrútlé fogyasztását kerülnie kell a Sunitinib-AZR-kezelés alatt.
Terhesség és szoptatás
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer szedése előtt beszéljen kezelőorvosával vagy gyógyszerészével.
Ha Ön teherbe eshet, akkor a Sunitinib-AZR-kezelés alatt megbízható fogamzásgátló módszert kell alkalmaznia.
Közölje kezelőorvosával, ha szoptat. Nem szabad szoptatnia a Sunitinib-AZR-kezelés alatt!
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
Ha szédülést tapasztal vagy szokatlanul fáradt, akkor különösen legyen óvatos, ha gépjárművet vezet vagy gépet kezel.
A Sunitinib-AZR nátriumot tartalmaz
A készítmény kevesebb mint 1 mmol (23 mg) nátriumot tartalmaz kapszulánként, azaz gyakorlatilag nátriummentes.
3. Hogyan kell szedni a Sunitinib-AZR készítményt?
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően szedje. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát.
A kezelőorvosa az Önnek megfelelő adagot fogja előírni, a kezelt daganattípustól függően. Amennyiben:
- GIST vagy MRCC miatt kezelik, a szokásos adag naponta egyszer 50 mg 28 napon (4 héten) keresztül, amit 14 nap (2 hét) gyógyszerszedési szünet követ, és mindezt 6 hetes ciklusokban ismételve.
- pNET miatt kezelik, a szokásos adag naponta egyszer 37,5 mg, szünet nélkül.
Kezelőorvosa fogja meghatározni az Önnek megfelelő adagot, valamint, hogy abba kell-e hagynia a Sunitinib-AZR-kezelést, és ha igen, mikor.
A Sunitinib-AZR bevehető étellel vagy a nélkül is.
(Lehúzható buborékfólia-csomagoláshoz)
A buborékcella felnyitásához válasszon le egy adagot a buborékcsomagolásról a perforált tépővonalak mentén. Ezután húzza le a fóliát a buborékcelláról, és vegye ki a kapszulát. Ne nyomja át a kapszulát a fólián, mert ez károsíthatja a kapszulát.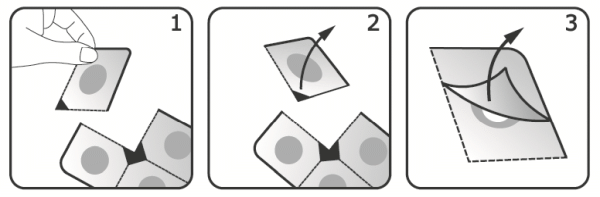
Ha az előírtnál több Sunitinib-AZR készítményt vett be
Ha véletlenül túl sok kapszulát vett be, azonnal tájékoztassa kezelőorvosát! Orvosi segítségre lehet szüksége.
Ha elfelejtette bevenni a Sunitinib-AZR készítményt
Ne vegyen be kétszeres adagot a kihagyott adag pótlására.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Azonnal keresse fel kezelőorvosát, ha az alábbi súlyos mellékhatások bármelyikét észleli (lásd még a "Tudnivalók a Sunitinib-AZR szedése előtt" című részt):
Szívproblémák. Mondja el kezelőorvosának, ha nagyon fáradtnak érzi magát, légszomja van, vagy a lába és bokája megdagadt. Ezek bizonyos szívbetegségek, köztük akár szívelégtelenség vagy szívizomproblémák (kardiomiopátia) tünetei lehetnek.
Tüdő- vagy légzési problémák. Mondja el kezelőorvosának, ha köhögni kezd, mellkasi fájdalom vagy hirtelen kialakuló légszomj lép fel Önnél, vagy vért köhög fel. Ezek a tüdőembóliának nevezett állapot tünetei lehetnek, ami akkor jelentkezik, ha vérrög kerül a tüdejébe.
Vesebetegségek. Mondja el kezelőorvosának, ha megváltozik a vizeletürítés gyakorisága, vagy nem ürít vizeletet, ami veseelégtelenség tünete lehet.
Vérzés. Mondja el kezelőorvosának, ha az alábbi tünetek bármelyike vagy súlyos vérzési probléma jelentkezik Önnél a Sunitinib-AZR-kezelés során: fájdalmas, felfúvódott has, véres hányás, fekete, kenőcsös széklet, véres vizelet, fejfájás vagy a mentális állapot megváltozása; vér vagy véres köpet felköhögése a tüdőből vagy a légutakból.
A daganat pusztulása, ami a bél kilyukadásához vezet. Mondja el kezelőorvosának, ha súlyos hasi fájdalmai, láza, hányingere van, ha hányt, véres a széklete vagy megváltoztak a székletürítési szokásai.
A szunitinib további mellékhatásai lehetnek a következők:
Nagyon gyakori (10-ből több mint 1 beteget érinthet)
- A vérlemezkék, vörösvértestek és/vagy fehérvérsejtek (például neutrofilek) számának csökkenése.
- Légszomj.
- Magas vérnyomás.
- Nagyfokú fáradtság, erőtlenség.
- Vizenyő okozta duzzanat, amit a bőr alatti és a szem környékén felhalmozódott folyadék okoz; mély allergiás bőrkiütés.
- A száj fájdalma/irritációja, a száj aftái/gyulladása/szárazsága, ízérzészavarok, gyomorpanasz, émelygés, hányás, hasmenés, székrekedés, hasi fájdalom/puffadás, étvágytalanság vagy étvágycsökkenés.
- A pajzsmirigy csökkent működése (hipotireózis).
- Szédülés.
- Fejfájás.
- Orrvérzés.
- Hátfájás, ízületi fájdalom.
- Kar- és lábfájdalom.
- Sárga színű bőr/a bőr elszíneződése, a bőr fokozott pigmentációja, hajszínváltozás, bőrkiütés a tenyéren és a talpon, bőrkiütés, bőrszárazság.
- Köhögés.
- Láz.
- Elalvási nehézség.
Gyakori (10-ből legfeljebb 1 beteget érinthet)
- Vérrögök az erekben.
- A szívizomzat vérellátásának elégtelensége, a koszorúerek elzáródása vagy szűkülete miatt.
- Mellkasi fájdalom.
- A szív által kipumpált vér mennyiségének csökkenése.
- Folyadék felhalmozódása, beleértve a tüdő körüli folyadék-felhalmozódást.
- Fertőzések.
- Súlyos fertőzés okozta szövődmény (a fertőzés a véráramban van jelen), amely szövetkárosodáshoz, szervelégtelenséghez és halálhoz vezethet.
- Csökkent vércukorszint (lásd 2., Tudnivalók a Sunitinib-AZR szedése előtt című pont).
- Fehérjevesztés a vizelettel, mely esetenként vizenyőt okoz.
- Influenzaszerű tünetek.
- Kóros vérvizsgálati eredmények, beleértve a hasnyálmirigy- és májenzimértékeket.
- Magas húgysavszint a vérben.
- Aranyeres csomók, fájdalom a végbélben, fogínyvérzés, nyelési nehézség vagy nyelési képtelenség.
- Égő érzés vagy fájdalom a nyelvben, az emésztőrendszer nyálkahártyájának a gyulladása, túlzott gázképződés a gyomorban vagy a belekben.
- Súlyvesztés.
- Mozgásszervi eredetű fájdalom (izom- és csontfájdalom), izomgyengeség, izomfáradtság, izomfájdalom, izomgörcsök.
- Orrszárazság, orrdugulás.
- Fokozott könnyezés.
- Szokatlan bőrérzékelés, viszketés, a bőr réteges hámlása és gyulladása, hólyagok, pattanások, a köröm elszíneződése, hajhullás.
- Szokatlan érzések a végtagokban.
- Kórosan csökkent/fokozott érzékelés, különösen tapintás esetén.
- Gyomorégés.
- Kiszáradás.
- Hőhullámok.
- Szokatlan színű vizelet.
- Depresszió.
- Hidegrázás.
Nem gyakori (100-ból legfeljebb 1 beteget érinthet)
- A lágyszövetek, beleértve a nemi szervek és a végbélnyílás környékét, életet veszélyeztető fertőzése (lásd 2., Tudnivalók a Sunitinib-AZR szedése előtt című pont).
- Agyi érkatasztrófa (sztrók).
- A szív vérellátásának megszűnése vagy csökkenése következtében bekövetkező szívroham.
- Változás a szív elektromos aktivitásában vagy szívritmuszavar.
- Folyadék felhalmozódása a szív körül (folyadékgyülem a szívburokban).
- Májelégtelenség.
- Hasi fájdalom, amit a hasnyálmirigy (pankreász) gyulladása okozott.
- A daganat pusztulása, mely a bél kilyukadásához (perforáció) vezet.
- Az epehólyag gyulladása (duzzanat és pirosság), epekővel vagy a nélkül.
- Sipoly (rendellenes csőszerű járat két testüreg vagy egy testüreg és a bőr között).
- Száj-, fog- és/vagy állkapocsfájdalom, duzzanat vagy afták a szájüregben, az állkapocs zsibbadása vagy elnehezülése vagy egy fog meglazulása. Ezek az állkapocscsont károsodása (csontelhalás) okozta panaszok és tünetek lehetnek, lásd 2., Tudnivalók a Sunitinib-AZR szedése előtt című pont.
- A pajzsmirigyhormonok túltermelődése, ami növeli a test által nyugalomban felhasznált energia mennyiségét.
- Műtét után kialakuló sebgyógyulási problémák.
- Az izmokból származó kreatin-foszfokináz enzim megnövekedett szintje a vérben.
- Allergénekre adott túlzott reakció, beleértve a szénanáthát, bőrkiütést, bőrviszketést, csalánkiütést, testrészek megduzzadását vagy légzési nehézséget is.
- Vastagbélgyulladás (kolitisz, iszkémiás kolitisz).
Ritka (1000-ből legfeljebb 1 beteget érinthet)
- A bőr és/vagy a nyálkahártyák súlyos reakciója (Stevens-Johnson-szindróma, toxikus epidermális nekrolízis, eritéma multiforme).
- Tumorlízis-szindróma (TLS) - a TLS az anyagcsere-szövődmények olyan csoportját jelenti, ami a rák kezelése közben alakulhat ki. Ezeket a szövődményeket a rákos sejtek pusztulásakor keletkező bomlástermékek okozzák, és ezek a szövődmények a következők lehetnek: hányinger, légszomj, szabálytalan szívverés, izomgörcs, görcsroham, a vizelet zavarossá válása és kóros vérvizsgálati eredményekkel (a vér magas kálium-, húgysav- és foszforszintje, valamint alacsony kalciumszintje) együtt járó fáradtság, mely a veseműködés megváltozását és akut veseelégtelenséget okozhat.
- Az izomszövet kóros szétesése, ami veseproblémákhoz vezethet (rabdomiolízis).
- Kóros elváltozások az agyban, melyek fejfájást, zavartságot, görcsöket és látásvesztést magában foglaló tünetegyüttest okozhatnak (reverzibilis poszterior leukoenkefalopátia szindróma).
- A bőr fájdalmas kifekélyesedése (pioderma gangrenózum).
- Májgyulladás (hepatitisz).
- A pajzsmirigy gyulladása.
- A legkisebb vérerek károsodása, úgynevezett trombotikus mikroangiopátia (TMA).
Nem ismert (a gyakoriság a rendelkezésre álló adatokból nem állapítható meg)
- Az érfal kiboltosulása és meggyengülése vagy érfalrepedés (aneurizma és artéria-disszekció).
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül: Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet, Postafiók 450, H-1372 Budapest, Magyarország, honlap: https://mellekhatas.ogyei.gov.hu/
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Sunitinib-AZR készítményt tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A dobozon, a tartályon és a buborékcsomagoláson feltüntetett lejárati idő (EXP) után ne szedje ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
A nedvességtől való védelem érdekében az eredeti csomagolásban tárolandó.
Ez a gyógyszer különleges tárolási hőmérsékletet nem igényel.
Ne alkalmazza ezt a gyógyszert, ha azt veszi észre, hogy a csomagolás megsérült vagy megkísérelték azt felnyitni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Sunitinib-AZR?
Sunitinib-AZR 12,5 mg kemény kapszula
A készítmény hatóanyaga a szunitinib. 12,5 mg szunitinibet tartalmaz (szunitinib-malát formájában) kapszulánként.
Egyéb összetevők:
- Kapszulatöltet: povidon, mikrokristályos cellulóz, kroszkarmellóz-nátrium, (lásd 2., Tudnivalók a Sunitinib-AZR szedése előtt című pont), magnézium-sztearát.
- Kapszulahéj: zselatin, titán-dioxid (E171), vörös vas-oxid (E172), sárga vas oxid (E172).
- Jelölőfesték: sellak, titán-dioxid (E171), propilénglikol.
Sunitinib-AZR 25 mg kemény kapszula
A készítmény hatóanyaga a szunitinib. 25 mg szunitinibet tartalmaz (szunitinib-malát formájában) kapszulánként.
Egyéb összetevők:
- Kapszulatöltet: povidon, mikrokristályos cellulóz, kroszkarmellóz-nátrium (lásd 2., Tudnivalók a Sunitinib-AZR szedése előtt című pont), magnézium-sztearát.
- Kapszulahéj: zselatin, titán-dioxid (E171), vörös vas-oxid (E172), sárga vas-oxid (E172), fekete vas-oxid (E172).
- Jelölőfesték: sellak, titán-dioxid (E171), propilénglikol.
Sunitinib-AZR 37,5 mg kemény kapszula
A készítmény hatóanyaga a szunitinib. 37,5 mg szunitinibet tartalmaz (szunitinib-malát formájában) kapszulánként.
Egyéb összetevők:
- Kapszulatöltet: povidon, mikrokristályos cellulóz, kroszkarmellóz-nátrium (lásd 2., Tudnivalók a Sunitinib-AZR szedése előtt című pont), magnézium-sztearát.
- Kapszulahéj: zselatin, titán-dioxid (E171), sárga vas-oxid (E172).
- Jelölőfesték: sellak, fekete vas-oxid (E172), propilénglikol.
Sunitinib-AZR 50 mg kemény kapszula
A készítmény hatóanyaga a szunitinib. 50 mg szunitinibet tartalmaz (szunitinib-malát formájában) kapszulánként.
Egyéb összetevők:
- Kapszulatöltet: povidon, mikrokristályos cellulóz, kroszkarmellóz-nátrium (lásd 2., Tudnivalók a Sunitinib-AZR szedése előtt című pont), magnézium-sztearát.
- Kapszulahéj: zselatin, titán-dioxid (E171), vörös vas-oxid (E172), sárga vas-oxid (E172), fekete vas-oxid (E172).
- Jelölőfesték: sellak, fekete vas-oxid (E172), propilénglikol.
Milyen a Sunitinib-AZR külleme és mit tartalmaz a csomagolás?
Sunitinib-AZR 12,5 mg kemény kapszula
Kemény zselatinkapszula narancssárga felső és alsó résszel, az alsó részen fehér "SNB" és "12,5" jelöléssel. A kapszula narancssárga granulátumot tartalmaz. A kapszula mérete: 4 (kb. 14 mm hosszúságú).
Sunitinib-AZR 25 mg kemény kapszula
Kemény zselatinkapszula karamellszínű (világosbarna) felső és narancssárga alsó résszel, az alsó részen fehér "SNB" és "25" jelöléssel. A kapszula narancssárga granulátumot tartalmaz. A kapszula mérete: 3 (kb. 16 mm hosszúságú).
Sunitinib-AZR 37,5 mg kemény kapszula
Kemény zselatinkapszula sárga felső és alsó résszel, az alsó részen fekete "SNB" és "37,5" jelöléssel. A kapszula narancssárga granulátumot tartalmaz. A kapszula mérete: 2 (kb. 18 mm hosszúságú).
Sunitinib-AZR 50 mg kemény kapszula
Kemény zselatinkapszula karamellszínű felső és karamellszínű (világosbarna) alsó résszel, az alsó részen fekete "SNB" és "50" jelöléssel. A kapszula narancssárga granulátumot tartalmaz. A kapszula mérete: 1 EL (hosszúkás, kb. 20 mm hosszúságú).
Kiszerelések:
- 30 db kemény kapszula nagysűrűségű polietilén (HDPE) tartályban szárítószerrel ellátott gyermekbiztos polipropilén (PP) kupakkal lezárva és dobozban.
- 28 vagy 30 db kemény kapszula szárítószerrel ellátott OPA/Al/PE//Al lehúzható buborékcsomagolásban és dobozban.
- 28 × 1, vagy 30 × 1 db kemény kapszula szárítószerrel ellátott OPA/Al/PE//Al adagonként perforált, lehúzható buborékcsomagolásban és dobozban.
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
A betegtájékoztató engedélyezésének dátuma: 2022.09.01.
