LENALIDOMIDE PHARMASCIENCE 10 mg kemény kapszula
Hatóanyag:
lenalidomide
Csak vényre kapható
Kiszerelés:
21x buborékcsomagolásban

Tájékoztató ár:
-
Normatív TB-támogatás:
Nem
Eü. emelt támogatás:
Nem
-
Gyógyszerfőkategória:
IMMUNSUPPRESSANSOK
-
Törzskönyvi szám:
OGYI-T-23730/02
-
Gyógyszeralkategória:
Egyéb immunsuppressansok
-
Gyártó:
Pharmascience International Ltd
Betegtájékoztató
1. Milyen típusú gyógyszer a Lenalidomide Pharmascience és milyen betegségek esetén alkalmazható?
Milyen típusú gyógyszer a Lenalidomide Pharmascience?
A Lenalidomide Pharmascience a lenalidomid nevű hatóanyagot tartalmazza. Ez a gyógyszer az immunrendszer működésére ható gyógyszerek csoportjába tartozik.
Milyen betegségek esetén alkalmazható a Lenalidomide Pharmascience?
A Lenalidomide Pharmascience-t felnőttek esetében
‐ mielóma multiplex
‐ mielodiszpláziás szindrómák
‐ follikuláris limfóma
kezelésére alkalmazzák.
Mielóma multiplex
A mielóma multiplex a rák egy típusa, amely a fehérvérsejtek egy bizonyos fajtáját, az úgynevezett plazmasejteket érinti. Ezek a sejtek felhalmozódnak a csontvelőben, és szabályozatlanul osztódnak. Ez károsíthatja a csontokat és a vesét.
A mielóma multiplex általában gyógyíthatatlan. A jeleket és tüneteket azonban egy ideig nagymértékben mérsékelni lehet vagy meg lehet szüntetni. Ezt nevezik "kezelésre adott válasznak".
Újonnan diagnosztizált mielóma multiplex - olyan betegeknél, akik csontvelő-átültetésen (transzplantáción) estek át
A Lenalidomide Pharmascience-t ilyen esetben a transzplantáció után megfelelően felépült betegnél önmagában, fenntartó kezelésre alkalmazzák.
Újonnan diagnosztizált mielóma multiplex - olyan betegeknél, akiknél nem lehet csontvelő-átültetést végezni
A Lenalidomide Pharmascience-t más gyógyszerekkel együtt alkalmazzák:
- a bortezomib nevű kemoterápiás gyógyszerrel,
- a dexametazon nevű gyulladásgátló gyógyszerrel,
- a melfalán nevű kemoterápiás gyógyszerrel, és
- a prednizon nevű, az immunrendszert elnyomó (immunszupresszív) gyógyszerrel.
Ezeket az egyéb gyógyszereket a kezelés elején fogja szedni, majd a továbbiakban önmagában kell szednie a Lenalidomide Pharmascience-t.
Ha Ön 75 éves vagy idősebb, vagy közepesen súlyos vesebetegségben szenved, kezelőorvosa gondosan ellenőrizni fogja az Ön állapotát a kezelés elkezdése előtt.
Mielóma multiplex - olyan betegek, akik korábban már részesültek kezelésben
A Lenalidomide Pharmascience-t a "dexametazon" nevű gyulladásgátló gyógyszerrel együtt kell szedni.
A Lenalidomide Pharmascience megállíthatja a mielóma multiplex okozta jelek és tünetek rosszabbodását. Kimutatták azt is, hogy késlelteti a mielóma multiplex kezelés utáni visszatérését.
Mielodiszpláziás szindrómák (MDS)
Az MDS számos különböző vér- és csontvelőbetegség gyűjtőneve. A vérsejtek kórossá válnak, és nem működnek megfelelően. A betegek egy sor különböző panaszt és tünetet, köztük alacsony vörösvértestszámot (vérszegénység) tapasztalhatnak, vérátömlesztésre szorulhatnak, és fokozott lehet a fertőzések kockázata.
A Lenalidomide Pharmascience-t olyan felnőtt betegeknél alkalmazzák önmagában, akiknél MDS-t diagnosztizáltak, amennyiben a következők mindegyike vonatkozik rájuk:
• rendszeresen vérátömlesztésre van szüksége ahhoz, hogy az alacsony vörösvértestszámát rendezni tudják ("transzfúzió-dependens anémia").
• a csontvelő sejtekben Önnél egy bizonyos "izolált 5q deléció típusú citogenetikai elváltozásnak" nevezett kórállapot áll fenn. Ez azt jelenti, hogy szervezete nem képes elegendő egészséges vérsejtet termelni.
• korábban egyéb kezelési eljárásokat alkalmaztak, melyek nem voltak megfelelőek vagy hatásuk nem volt elég jó.
A Lenalidomide Pharmascience a szervezet által termelt kóros sejtek számának csökkentésével emelheti az egészséges vörösvértestek számát:
• ezzel csökkenthető a szükséges vérátömlesztések száma. Lehetséges, hogy egyáltalán nem lesz szükség vérátömlesztésre.
Follikuláris limfóma (FL)
Az FL egy olyan lassan növekvő daganat, amely a B-limfocitákat érinti. Ez olyan fehérvérsejt-típus, amely segít a szervezetnek a fertőzések elleni küzdelemben. FL-ben szenvedő betegeknél a vérben, a csontvelőben, a nyirokcsomókban és a lépben túl sok B-limfocita szaporodhat fel.
Korábban már kezelt follikuláris limfómában szenvedő felnőtt betegeknek a Lenalidomide Pharmascience-t egy másik gyógyszerrel, az úgynevezett rituximabbal együtt kell szedniük.
Hogyan hat a Lenalidomide Pharmascience?
A Lenalidomide Pharmascience a szervezet immunrendszerére hat, és közvetlenül a rákot támadja meg. Többféle módon fejti ki hatását:
- a rákos sejtek fejlődésének leállításával,
- az erek daganatba való benövésének leállításával,
- az immunrendszer egy részének serkentésével, hogy az megtámadja a rákos sejteket.
2. Tudnivalók a Lenalidomide Pharmascience szedése előtt
Mielőtt megkezdené a Lenalidomide Pharmascience-kezelést, feltétlenül el kell olvasnia a Lenalidomide Pharmascience-szel együtt szedendő összes gyógyszer betegtájékoztatóját.
Ne szedje a Lenalidomide Pharmascience-t:
- ha Ön terhes, azt gondolja, hogy terhes lehet vagy terhességet tervez, mivel a Lenalidomide Pharmascience várhatóan ártalmas a születendő gyermek számára (lásd 2. pont, "Terhesség, szoptatás és fogamzásgátlás - információk nők és férfiak számára").
- ha teherbe eshet, kivéve, ha minden szükséges intézkedést megtesz a teherbe esés elkerülésére (lásd 2. pont, "Terhesség, szoptatás és fogamzásgátlás - információk nők és férfiak számára"). Ha teherbe eshet, orvosa minden újabb adag felírásakor feljegyzi, hogy Ön minden szükséges óvintézkedést megtett, és erről Önnek is ad egy igazolást.
- ha allergiás a lenalidomidra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére. Ha úgy gondolja allergiás lehet, kérje kezelőorvosa tanácsát.
Amennyiben ezek közül bármelyik érvényes Önre, ne szedje a Lenalidomide Pharmascience-t. Ha nem biztos ebben, beszéljen kezelőorvosával.
Figyelmeztetések és óvintézkedések
A Lenalidomide Pharmascience szedése előtt beszéljen kezelőorvosával, gyógyszerészével vagy a gondozását végző egészségügyi szakemberrel, ha:
- régebben vérrögképződés fordult elő Önnél - fokozott lehet a kezelés alatt a vérrögök kialakulásának kockázata a visszerekben és a verőerekben;
- fertőzés bármilyen jele áll fenn Önnél, például köhögés vagy láz;
- jelenleg vírusfertőzésben szenved vagy szenvedett korábban bármikor, különös tekintettel a hepatitisz B fertőzésre, Varicella zoster fertőzésre, HIV-re. Ha nem biztos ebben, beszéljen kezelőorvosával. A Lenalidomide Pharmascience-kezelés a vírust hordozó betegeknél újra aktivizálhatja a vírust, ami a fertőzés kiújulását eredményezi. Kezelőorvosának ellenőriznie kell, hogy volt-e Önnek korábban hepatitisz B fertőzése.
- veseproblémái vannak - kezelőorvosa módosíthatja az Ön Lenalidomide Pharmascience adagját;
- ha volt szívrohama, valaha vérrögöt találtak az ereiben vagy amennyiben dohányzik, magas a vérnyomása, illetve magas a koleszterinszintje;
- talidomid (egy másik gyógyszer, amelyet mielóma multiplex kezelésére alkalmaznak) szedése során allergiás reakciók léptek fel, például bőrkiütés, viszketés, duzzanat, szédülés vagy légzési nehézség;
- korábban a következő tünetek bármelyikének kombinációját tapasztalta: nagy kiterjedésű bőrkiütések, bőrpír, magas testhőmérséklet, influenzaszerű tünetek, emelkedett májenzimszintek, kóros vérképeltérések (eozinofília), megnagyobbodott nyirokcsomók - ezek egy súlyos bőrreakció, az ún. eozinofil fehérvérsejtek számának emelkedésével és szisztémás tünetekkel járó gyógyszerreakció, más néven DRESS vagy gyógyszer-túlérzékenységi szindróma tünetei, lásd még 4. pont, "Lehetséges mellékhatások").
Amennyiben a fentiek bármelyike vonatkozik Önre, szóljon kezelőorvosának a kezelés megkezdése előtt.
Azonnal számoljon be orvosának vagy a kezelését végző egészségügyi szakembernek, ha bármikor a kezelés alatt vagy azután a következőket tapasztalja:
-- homályos látás, látásvesztés vagy kettős látás, beszédnehezítettség, a kar vagy a láb gyengesége, a járásában bekövetkező változás vagy egyensúlyproblémák, hosszan tartó zsibbadás, csökkent érzékelés vagy érzéskiesés, emlékezetkiesés vagy zavartság. Ezek bármelyike tünete lehet a súlyos és potenciálisan halálos kimenetelű, progresszív multifokális enkefalopátiának (PML) nevezett agyi betegségnek. Amennyiben a fenti tünetek fennálltak Önnél a lenalidomid-kezelés előtt, a tünetekkel kapcsolatos bármilyen változásról számoljon be orvosának.
-- légszomjat, fáradtságot, szédülést, mellkasi fájdalmat, gyorsabb szívverést vagy láb- vagy bokaduzzanatot tapasztal. Ezek a pulmonalis hipertónia néven ismert súlyos állapot tünetei lehetnek (lásd 4. pont).
Vizsgálatok és ellenőrzések
A Lenalidomide Pharmascience-kezelés előtt és alatt Önnél rendszeresen vérvizsgálatot fognak végezni Erre azért van szükség, mert a Lenalidomide Pharmascience hatására csökkenhet a fertőzések ellen védő (fehérvérsejtek) és a véralvadást elősegítő vérsejtek (vérlemezkék) száma.
Kezelőorvosa vérvizsgálatra fogja Önt küldeni:
‐ a kezelés előtt,
‐ a kezelés első 8 hete során minden héten,
‐ és ezután minden hónapban legalább egyszer.
A lenalidomid-kezelés előtt és alatt kivizsgálhatják kardiopulmonális problémák tüneteire.
MDS-ben szenvedő, Lenalidomide Pharmascience-t szedő betegek
Ha MDS-ben szenved, akkor Önnél nagyobb a valószínűsége egy előrehaladottabb kórállapot, az úgynevezett akut mieloid leukémia (AML) kialakulásának. Ráadásul nem ismert, hogy a Lenalidomide Pharmascience hogyan befolyásolja az AML kialakulásának esélyét. Kezelőorvosa ezért vizsgálatokat végeztethet, amelyekkel ellenőrzi azokat a jeleket, amelyek alapján jobban előrejelezhető az AML kialakulásának valószínűsége a Lenalidomide Pharmascience-szel végzett kezelés során.
FL-ben szenvedő, Lenalidomide Pharmascience-t szedő betegek
Kezelőorvosa vérvizsgálatra fogja Önt küldeni:
‐ a kezelés megkezdése előtt
‐ a kezelés első 3 hete során (1. ciklus) minden héten
‐ ezután a 2.-4. ciklusban 2 hetente (további információért lásd 3. pont: Kezelési ciklus)
‐ Ezt követően az egyes ciklusok elején fog rá sor kerülni, valamint
‐ minden hónapban legalább egyszer.
Kezelőorvosa ellenőrizheti, hogy összességében nem túl nagy-e az Ön szervezetében található daganatszövet mennyisége, a csontvelőt is beleértve. Ez egy olyan állapot kialakulásához vezethet, amikor a daganatok szétesnek és a vérben lévő vegyianyagok szintjét a megszokottól eltérőre változtatják, ami veseelégtelenséghez vezethet (ezt a kórállapotot "tumorlízis-szindrómának" nevezik).
Kezelőorvosa ellenőrizheti Önnél a bőrelváltozások, például vörös foltok vagy kiütések, megjelenését.
Kezelőorvosa módosíthatja a Lenalidomide Pharmascience adagját vagy leállíthatja a kezelést, ha a vérvizsgálat eredménye vagy az Ön általános egészségi állapota azt indokolja. Ha Önnél újonnan állapították meg a betegséget, akkor kezelőorvosa az életkor és az Önnél már eleve fennálló egyéb betegségek alapján is értékelheti a kezelést.
Véradás
Ön nem adhat vért a kezelés alatt, illetve annak befejezése után 1 hétig.
Gyermekek és serdülők
A Lenalidomide Pharmascience alkalmazása nem ajánlott gyermekek és 18 év alatti serdülők számára.
Idősek és vesebetegek
Ha Ön 75 éves vagy idősebb, vagy közepesen súlyos, illetve súlyos fokú vesebetegsége van, kezelőorvosa gondosan ki fogja vizsgálni az Ön állapotát a kezelés megkezdése előtt.
Egyéb gyógyszerek és a Lenalidomide Pharmascience
Feltétlenül tájékoztassa kezelőorvosát vagy a gondozását végző egészségügyi szakembert a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről. Erre azért van szükség, mert a Lenalidomide Pharmascience befolyásolhatja egyes gyógyszerek hatását, bizonyos gyógyszerek pedig befolyásolhatják azt, hogy miként hat a Lenalidomide Pharmascience.
Különösen fontos, hogy szóljon kezelőorvosának vagy a gondozását végző egészségügyi szakembernek, ha az alábbi gyógyszerek valamelyikét szedi:
‐ bizonyos gyógyszerek, melyek a terhességet megelőzésére szolgálnak, például a szájon át szedhető fogamzásgátlók, mivel megszűnhet ezek hatása;
‐ bizonyos szívproblémák kezelésére szolgáló gyógyszerek - például a digoxin;
‐ bizonyos vérhígító gyógyszerek - például a warfarin.
Terhesség, szoptatás és fogamzásgátlás - tájékoztató nők és férfiak számára
Terhesség
Lenalidomide Pharmascience-t szedő nőkre vonatkozóan
‐ A Lenalidomide Pharmascience-t nem szabad a terhesség alatt szedni, mert az várhatóan ártalmas a születendő gyermekre.
‐ A Lenalidomide Pharmascience szedése alatt nem szabad teherbe esnie. Ezért ha Ön fogamzóképes nő, akkor hatékony fogamzásgátló módszert kell alkalmaznia (lásd alább: "Fogamzásgátlás").
‐ Amennyiben teherbe esik a Lenalidomide Pharmascience-kezelés alatt, a kezelést haladéktalanul meg kell szakítania, és értesítenie kell kezelőorvosát.
Lenalidomide Pharmascience-t szedő férfiakra vonatkozóan
- Ha partnere teherbe esik azalatt, amíg Ön Lenalidomide Pharmascience-t szed, haladéktalanul értesítse kezelőorvosát. Partnerének ajánlatos orvoshoz fordulnia.
- Önnek is hatékony fogamzásgátló módszert kell alkalmaznia (lásd alább: "Fogamzásgátlás").
Szoptatás
A Lenalidomide Pharmascience szedése alatt nem szabad szoptatnia, mivel nem ismert, hogy a Lenalidomide Pharmascience bejut-e az anyatejbe.
Fogamzásgátlás
Lenalidomide Pharmascience-t szedő nőkre vonatkozóan
A kezelés megkezdése előtt kérdezze meg kezelőorvosát, hogy Ön teherbe eshet-e, még abban az esetben is, ha Ön úgy gondolja, hogy ez valószínűtlen.
Ha Ön teherbe eshet:
- orvosi felügyelet mellett terhességi tesztet kell végeznie (minden kezelés előtt, a kezelés során 4 hetente, és 4 héttel a kezelés befejezése után), kivéve abban az esetben, ha igazolták, hogy a petevezetéket műtétileg lekötötték és a petesejtek nem juthatnak el a méhbe (petevezeték-lekötés),
ÉS
- hatékony fogamzásgátló módszert kell alkalmaznia a kezelés előtt 4 hétig, a kezelés során és az azt követő 4 héten keresztül. Kezelőorvosa tájékoztatni fogja a megfelelő fogamzásgátló módszerekről.
A Lenalidomide Pharmascience-t szedő férfiakra vonatkozóan
A Lenalidomide Pharmascience bejut az ondóba. Ha az Ön nőpartnere terhes vagy fogamzóképes, és nem alkalmaz hatékony fogamzásgátló módszereket, akkor Önnek óvszert kell használnia a kezelés ideje alatt, valamint a kezelés befejezése után legalább 7 napig, még akkor is, ha Önnél átvágták az ondóvezetékeket (vazektómián esett át). Ön nem adhat ondót vagy spermát a kezelés során, illetve annak befejezése után legalább 7 napig.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A Lenalidomide Pharmascience bevétele után ne vezessen gépjárművet vagy ne kezeljen gépeket, ha szédül, fáradt, álmos, forgó jellegű szédülése (vertigó) van, vagy homályos látást tapasztal.
A Lenalidomide Pharmascience laktózt, tartazint, Sunset Yellow FCF-et és Alluravörös AC-t tartalmaz
A Lenalidomide Pharmascience kapszula laktózt tartalmaz. Ritkán előforduló, örökletes galaktóz intoleranciában, teljes laktáz hiányban vagy glükóz galaktóz malabszorpcióban a készítmény nem szedhető.
A készítmény kevesebb, mint 1 mmol (23 mg) nátriumot tartalmaz kapszulánként, azaz gyakorlatilag "nátriummentes".
Lenalidomide S Pharmascience tada 10 mg
A Lenalidomide Pharmascience 10 mg kapszula tartrazint (E102), Sunset yellow FCF-et (E110) és Alluravörös AC-t (E129) tartalmaz, amelyek allergiás reakciókat okozhatnak.
Lenalidomide Pharmascience 15 mg
A Lenalidomide Pharmascience 15 mg kapszula tartrazint (E102), és Alluravörös AC-t (E129) tartalmaz, amelyek allergiás reakciókat okozhatnak.
3. Hogyan kell szedni a Lenalidomide Pharmascience-t?
A Lenalidomide Pharmascience-t mielóma multiplex, vagy FL kezelésében járatos orvosnak kell felírnia az Ön számára.
- Amikor a Lenalidomide Pharmascience-t mielóma multiplex kezelésére alkalmazzák olyan betegeknél, akiknél nem lehet csontvelő-átültetést végezni, vagy korábban már kaptak másféle kezelést, a Lenalidomide Pharmascience-t más gyógyszerekkel együtt kell szedni (lásd 1. pont: "Milyen betegségek kezelésére alkalmazható a Lenalidomide Pharmascience?").
- Amikor a Lenalidomide Pharmascience-t mielóma multiplex kezelésére alkalmazzák csontvelő-átültetésen átesett betegeknél, a gyógyszert önmagában kell szedni.
- Amikor a Lenalidomide Pharmascience-t follikuláris limfóma kezelésére alkalmazzák, a Lenalidomide Pharmascience-t a rituximab nevű gyógyszerrel együtt kell szedni.
A Lenalidomide Pharmascience-t mindig a kezelőorvosa által elmondottaknak megfelelően szedje. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Ha a Lenalidomide Pharmascience-t más gyógyszerekkel együtt szedi, akkor az alkalmazásukra és a hatásaikra vonatkozó további információkat illetően olvassa el ezen gyógyszerek betegtájékoztatóit.
Kezelési ciklus
A Lenalidomide Pharmascience-t 3 hetes időszakok (21 nap) bizonyos napjain kell bevenni.
- Minden 21 napos időszakot egy "kezelési ciklusnak" nevezünk.
- A ciklus napjától függően egy vagy több gyógyszert fog bevenni. Bizonyos napokon azonban egyik gyógyszert sem kell bevennie.
- Az egyes 21 napos ciklusok befejezése után az elkövetkezendő 21 napban új "ciklust" kell kezdenie.
VAGY
A Lenalidomide Pharmascience-t 4 hetes időszakok (28 nap) bizonyos napjain kell bevenni.
- Minden 28 napos időszakot egy "kezelési ciklusnak" nevezünk.
- A ciklus napjától függően egy vagy több gyógyszert fog bevenni. Bizonyos napokon azonban egyik gyógyszert sem kell bevennie.
- Az egyes 28 napos ciklusok befejezése után az elkövetkezendő 28 napban új "ciklust" kell kezdenie.
Mennyi Lenalidomide Pharmascience-t kell szedni?
A kezelés megkezdése előtt kezelőorvosa elmondja Önnek, hogy:
- mennyi Lenalidomide Pharmascience-t kell szednie;
- az egyéb gyógyszerekből mennyit kell bevennie (ha kell egyáltalán) a Lenalidomide Pharmascience-szel együtt;
- a kezelési ciklus mely napjain kell bevenni az egyes gyógyszereket.
Hogyan, és mikor kell bevenni a Lenalidomide Pharmascience-t?
- A kapszulákat egészben, lehetőleg vízzel kell lenyelnie.
- Ne törje össze, ne nyissa fel, vagy ne rágja meg a kapszulákat! Ha a sérült Lenalidomide Pharmascience kapszulából származó por érintkezésbe kerül a bőrével, azonnal alaposan le kell mosni szappannal és vízzel.
- Az egészségügyi szakembereknek, gondozóknak és családtagoknak eldobható kesztyűt kell viselniük a buborékcsomagolás, illetve a kapszula kezelésekor. Ezt követően a kesztyűt körültekintően kell levenni a bőrexpozíció elkerülése érdekében, majd lezárható műanyag polietilén zsákba kell helyezni és hulladékként kell kezelni a helyi előírásoknak megfelelően. Ezután pedig szappannal és vízzel alaposan kezet kell mosni. A várandós vagy vélhetően várandós nőknek tilos kezelniük a buborékcsomagolást vagy a kapszulát.
- A kapszulákat étellel együtt vagy anélkül is beveheti.
- A Lenalidomide Pharmascience-t a beütemezett napokon, hozzávetőleg ugyanabban az időpontban kell bevennie.
A gyógyszer bevétele
Ahhoz, hogy a kapszulát eltávolítsa a buborékcsomagolásból:
- csak a kapszula egyik végét nyomja ki a fólián keresztül.
- ne nyomja meg a kapszula közepét, mert ez a kapszula törését okozhatja.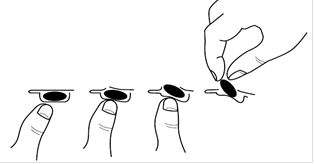
A Lenalidomide Pharmascience-kezelés időtartama
A Lenalidomide Pharmascience-t kezelési ciklusokban kell szedni, minden egyes ciklus 21, vagy 28 napig tart (lásd feljebb, "Kezelési ciklus"). A kezelési ciklusokat mindaddig folytatnia kell, amíg kezelőorvosa el nem rendeli a kezelés leállítását.
Ha az előírtnál több Lenalidomide Pharmascience-t vett be
Ha az előírtnál több Lenalidomide Pharmascience-t vett be, haladéktalanul tájékoztassa kezelőorvosát.
Ha elfelejtette bevenni a Lenalidomide Pharmascience-t
Ha elfelejtette bevenni a Lenalidomide Pharmascience-t a szokott időben és
- kevesebb mint 12 óra telt el azóta: azonnal vegye be a kapszulát.
- több mint 12 óra telt el azóta: ne vegye be a kapszulát. A következő napon a megszokott időben vegye be a következő kapszulát.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így a Lenalidomide Pharmascience is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Hagyja abba a Lenalidomide Pharmascience szedését, és haladéktalanul forduljon kezelőorvosához, ha a következő súlyos mellékhatások bármelyikét tapasztalja - Önnek sürgős orvosi ellátásra lehet szüksége:
- Csalánkiütés, bőrkiütés, a szem, száj vagy arc duzzanata, légszomj vagy bőrviszketés, amelyek az angioödéma vagy anafilaxiás reakció nevű súlyos allergiás reakciók tünetei lehetnek.
- Súlyos allergiás reakció, ami kezdődhet körülírt területen jelentkező bőrkiütéssel, majd továbbterjedhet az egész testre, a bőr kiterjedt leválását okozva (Stevens-Johnson-szindróma és/vagy toxikus epidermális nekrolízis).
- Nagy kiterjedésű bőrkiütések, magas testhőmérséklet, emelkedett májenzimszintek, kóros vérkép (eozinofília), nyirokcsomó-megnagyobbodás és más szervek érintettsége (eozinofiliával és szisztémás tünetekkel járó gyógyszerreakció, más néven DRESS vagy gyógyszer-túlérzékenységi szindróma). Lásd még 2. pont.
Azonnal tájékoztatnia kell kezelőorvosát, ha a z alábbi súlyos mellékhatások bármelyikét tapasztalja:
- Láz, hidegrázás, torokgyulladás, köhögés, fekély a szájban vagy fertőzés (beleértve a véráramban kialakuló fertőzést is (szepszis)).
- Sérülés nélküli vérzés vagy véraláfutás;
- Mellkasi fájdalom vagy lábfájdalom;
- Nehézlégzés.
- Csontfájdalom, izomgyengeség, zavartság vagy fáradtság, amelyek a vér magas kalciumszintjének következményei lehetnek.
A Lenalidomide Pharmascience csökkentheti a fertőzésektől védő fehérvérsejtek, valamint a véralvadást segítő vérsejtek (vérlemezkék) számát, ami vérzészavarokhoz vezethet, például orrvérzéshez vagy véraláfutások kialakulásához. A Lenalidomide Pharmascience-kezelés a visszerekben vérrögképződéshez vezethet (trombózis).
Egyéb mellékhatások
Fontos figyelembe venni, hogy néhány betegnél kialakulhatnak egyéb típusú daganatos betegségek, és ennek kockázatát a Lenalidomide Pharmascience-kezelés növelheti. Emiatt kezelőorvosának alaposan értékelnie kell az előnyöket és kockázatokat, amikor Lenalidomide Pharmascience-t ír fel Önnek.
Nagyon gyakori mellékhatások (10-ből több mint 1 beteget érinthet):
- a vörösvérsejtek számának csökkenése, ami fáradtsággal és gyengeséggel járó vérszegénységet okozhat;
- bőrkiütések, viszketés;
- izomgörcsök, izomgyengeség, izomfájdalom, csontfájdalom, ízületi fájdalom, hátfájás, végtagfájdalom;
- egész testre, köztük a karra és lábra is kiterjedő duzzanatok;
- gyengeség, fáradtság;
- láz és influenzaszerű tünetek, például láz, izomfájdalom, fejfájás, fülfájás és hidegrázás;
- zsibbadás, bizsergő, illetve égő érzés a bőrön, kéz, illetve lábfájdalom, szédülés, remegés;
- étvágycsökkenés, az ízérzésben bekövetkező változás;
- a fájdalomnak, a tumor méretének és a tumor körüli pirosságnak a fokozódása;
- testtömegcsökkenés;
- székrekedés, hasmenés, hányinger, hányás, hasi fájdalom, gyomorégés;
- a vér alacsony kálium-, kalcium- és/vagy nátriumszintje;
- a normálisnál alacsonyabb pajzsmirigyműködés;
- lábfájás (ami a trombózis egyik tünete lehet), mellkasi fájdalom vagy légszomj (amit a tüdőben található véralvadékok, az úgynevezett tüdőembólia okozhat);
- bármilyen típusú fertőzés, beleértve az orr körüli melléküregek fertőzését, a tüdő és a felső légutak fertőzését;
- légszomj;
- homályos látás;
- a szemlencse felhősödése (szürkehályog);
- veseproblémák, például nem megfelelő veseműködés, vagy a normális veseműködés fenntartásának képtelensége;
- kóros májfunkciós vizsgálati eredmények;
- emelkedett májfunkciós vizsgálati eredmények;
- a vérben található egyik fehérje szintjében bekövetkező változás, amely a verőerek duzzanatát okozhatja (vaszkulitisz);
- a vércukorszint megemelkedése (cukorbetegség);
- a vércukorszint csökkenése;
- fejfájás;
- orrvérzés;
- száraz bőr;
- depresszió, hangulatváltozás, alvásproblémák;
- köhögés;
- vérnyomáscsökkenés;
- bizonytalan, kellemetlen testi érzés, rossz közérzet;
- fájdalmas, gyulladt száj, szájszárazság;
- kiszáradás.
Gyakori mellékhatások (10-ből legfeljebb 1 beteget érinthet):
- a vörösvértestek pusztulása (hemolítikus anémia);
- bizonyos típusú bőrdaganatok;
- íny-, gyomor-, illetve bélvérzés;
- megemelkedett vérnyomás, lassú, gyors vagy szabálytalan szívverés;
- olyan anyagok mennyiségének megemelkedése, amelyek a vörösvértestek természetes, illetve kóros pusztulásából származnak;
- a szervezetben lévő gyulladást jelző fehérje szintjének emelkedése;
- a bőr sötétebbé válása, a bőr elszíneződése a bőr alatti vérzés miatt, amit jellemzően sérülés okoz, vérzés miatti bőrduzzanat, véraláfutás;
- a húgysavszint megemelkedése a vérben;
- bőrkiütés, bőrpír, a bőr berepedése, hámlása vagy leválása, csalánkiütés;
- fokozott verejtékezés, éjszakai verejtékezés;
- nyelési nehézség, torokfájás, a hang minőségével kapcsolatos problémák, illetve a hang megváltozása;
- orrfolyás;
- a szokásosnál sokkal több vagy sokkal kevesebb mennyiségű vizelet termelődése, vagy a vizeletürítés szabályozására való képtelenség;
- vér megjelenése a vizeletben;
- légszomj, különösen lefekvéskor (ami a szívelégtelenség tünete lehet);
- merevedési zavarok;
- szélütés, ájulás, vertigo (a belső fül rendellenessége, ami miatt úgy érzi, hogy minden forog), átmeneti eszméletvesztés;
- a karba, a nyakba, az állkapocsba, a hátba vagy a gyomorba sugárzó mellkasi fájdalom, verejtékezés és légszomj, hányinger vagy hányás, amelyek szívroham (miokardiális infarktus) tünetei lehetnek;
- izomgyengeség, energiahiány;
- nyakfájdalom, mellkasi fájdalom;
- hidegrázás;
- ízületi duzzanat;
- ízületi duzzanat;
- epeáramlás lelassulása vagy elzáródása;
- a vér alacsony foszfát-, illetve magnéziumszintje;
- beszédzavar;
- májkárosodás;
- egyensúlyzavar, mozgászavar;
- süketség fülcsengés (fülzúgás);
- idegi eredetű fájdalom, kellemetlen kóros érzékelés, különösen érintésre;
- vastöbblet a szervezetben;
- szomjúság;
- zavartság;
- fogfájás;
- elesés, ami sérüléshez vezethet.
Nem gyakori mellékhatások (100-ból legfeljebb 1 beteget érinthet):
- koponyán belüli vérzés;
- keringési zavarok;
- látásvesztés;
- a libidó (szexuális vágy) elvesztése;
- nagy mennyiségű vizelet ürítése, csontfájdalom és gyengeség, amelyek egy vesebetegség (Fanconi-szindróma) tünetei lehetnek;
- a bőr, a nyálkahártya vagy a szemek sárga elszíneződése (sárgaság), halvány színű széklet, sötét színű vizelet, bőrviszketés, kiütés, hasi fájdalom vagy haspuffadás - ezek májkárosodás (májbetegség) tünetei lehetnek;
- gyomorfájdalom, felfúvódás vagy hasmenés, melyek a vastagbél gyulladásának (kolitisznak vagy cöcitisznek is nevezik) tünetei lehetnek;
- a vese sejtjeinek károsodása (úgynevezett renális tubuláris nekrózis);
- a bőr színének megváltozása, napfényérzékenység;
- Tumor lízis szindróma - az anyagcserét érintő szövődmények, amelyek a daganat kezelése során, és néha akár kezelés nélkül is jelentkezhetnek. Ezeket a szövődményeket a széteső daganatos sejtek bomlástermékei okozzák, és a következők lehetnek: a vér kémiai összetétele megváltozik - magas kálium-, foszfát- és húgysav-, valamint alacsony kalciumszint alakul ki, ami a veseműködés és a szívverés megváltozásához, görcsrohamok kialakulásához és néha halálhoz vezet.
- magas vérnyomás a tüdőerekben (pulmonális hipertónia).
Nem ismert (a gyakoriság a rendelkezésre álló adatokból nem állapítható meg):
- hirtelen fellépő vagy enyhe, de súlyosbodó felhasi és/vagy hátfájás, amely néhány napig fennmarad, és esetlegesen hányinger, hányás, láz és szapora szívverés kísérheti. Ezeket a tüneteket hasnyálmirigy-gyulladás okozhatja.
- sípoló légzés, nehézlégzés vagy száraz köhögés, amelyek a tüdőszövetek gyulladásának tünetei lehetnek;
- az izmok lebomlásának (rabdomiolízis) (izomfájdalom, -gyengeség vagy -duzzanat) ritka, esetlegesen veseproblémákhoz vezető eseteit figyelték meg, melyek közül néhány eset a Lenalidomide Pharmascience sztatinnal (a koleszterinszint-csökkentő gyógyszerek egy típusa) együtt történő alkalmazása mellett fordult elő;
- a bőrt érintő betegség, amelyet a kis vérerek gyulladása okoz, és ízületi fájdalommal, valamint lázzal jár (leukocitoklasztos vaszkulitisz);
- a gyomor- vagy a bélfal károsodása. Ez nagyon súlyos fertőzéshez vezethet. Erős hasi fájdalom, láz, hányinger, hányás, véres széklet jelentkezése vagy a székelési szokások megváltozása esetén szóljon kezelőorvosának.
- vírusfertőzések, beleértve a herpesz zosztert (más néven "övsömör", fájdalmas, hólyagos bőrkiütést okozó vírusbetegség), valamint a hepatitisz B fertőzés kiújulását (ami a bőr és a szemek sárgás elszíneződését, sötétbarna színű vizeletet, jobb oldali hasi fájdalmat, lázat, hányingert vagy hányást okozhat);
- átültetett szerv (például vese, szív) kilökődése.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül:
Nemzeti Népegészségügyi és Gyógyszerészeti Központ, Postafiók 450, H-1372 Budapest
honlap: https://ogyei.gov.hu
elektronikus bejelentő form: https://mellekhatas.ogyei.gov.hu/
e-mail: adr.box@nngyk.gov.hu
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Lenalidomide Pharmascience-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A buborékcsomagoláson és a dobozon feltüntetett lejárati idő (EXP) után ne szedje a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Ez a gyógyszer nem igényel különleges tárolást.
Ne alkalmazza a gyógyszert, ha a csomagolása megsérült vagy már felbontották.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a fel nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Lenalidomide Pharmascience?
Lenalidomide Pharmascience 10 mg kemény kapszula:
- A készítmény hatóanyaga a lenalidomid. 10 mg lenalidomidot tartalmaz kapszulánként.
- Egyéb összetevők:
-- A kapszula tartalma: laktóz (lásd 2. pont), mikrokristályos cellulóz, kroszkarmellóz-nátrium és magnézium-sztearát
-- Kapszulahéj: Brillantkék FCF (E133), Alluravörös AC (E129) (lásd 2. pont), tartrazin (E102) (lásd 2. pont), Sunset Yellow FCF (E110) (lásd 2. pont), titan-dioxid (E171) és zselatin
-- Jelölőfesték: sellak, propilén-glikol (E1520), fekete vas-oxid (E172), és kálium-hidroxid.
Lenalidomide Pharmascience 15 mg kemény kapszula:
- A készítmény hatóanyaga a lenalidomid. 15 mg lenalidomidot tartalmaz akpszulánként.
- Egyéb összetevők:
-- A kapszula tartalma: laktóz (lásd 2. pont), mikrokristályos cellulóz, kroszkarmellóz-nátrium és magnézium-sztearát
-- Kapszulahéj: Brillantkék FCF (E133), Alluravörös AC (E129) (lásd 2. pont), tartrazin (E102) (lásd 2. pont), fekete vas-oxid (E172) vörös vas-oxid (E172) sárga vas-oxid (E172), titan-dioxid (E171) és zselatin
-- Jelölőfesték: sellak, propilén-glikol (E1520), fekete vas-oxid (E172) és kalium-hidroxid.
Lenalidomide Pharmascience 25 mg kemény kapszula:
- A készítmény hatóanyaga a lenalidomid. 5 mg lenalidomidot tartalmaz kapszulánként.
- Egyéb összetevők:
-- A kapszula tartalma: laktóz (lásd 2. pont), mikrokristályos cellulóz, kroszkarmellóz-nátrium és magnézium-sztearát
-- Kapszulahéj: titan-dioxid (E171) és zselatin
-- Jelölőfesték: sellak, propilén-glikol (E1520), fekete vas-oxid (E172) és kalium-hidroxid.
Milyen a Lenalidomide Pharmascience külleme és mit tartalmaz a csomagolás?
Lenalidomide Pharmascience 10 mg kemény kapszula
Felül átlátszatlan sárga, alul átlátszatlan szürke, fehér port tartalmazó, 0-ás méretű (21-22 mm-es) kemény kapszula, felül fekete "LP", alul "639" jelöléssel,
Lenalidomide Pharmascience 15 mg kemény kapszula
Felül átlátszatlan barna, alul átlátszatlan szürke, fehér port tartalmazó, 2-es méretű (18-19 mm-es) kemény kapszula, felül fekete "LP", alul "640" jelöléssel,
Lenalidomide Pharmascience 25 mg kemény kapszula
Felül átlátszatlan fehér, alul átlátszatlan fehér, fehér port tartalmazó, 0-ás méretű (21-22 mm-es) kemény kapszula, felül fekete "LP", alul "642" jelöléssel,
7 db vagy 21 db kapszulát tartalmazó polivinil-klorid (PVC)/poliklór-trifluoretilén (PCTFE)/alumínium buborékcsomagolás dobozban.
Lenalidomide Pharmascience 10 mg kemény kapszula
7 db vagy 21 db kapszula. Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
Lenalidomide Pharmascience 15 mg kemény kapszula
7 db vagy 21 db kapszula. Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
Lenalidomide Pharmascience 25 mg kemény kapszula
7 db vagy 21 db kapszula. Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
A betegtájékoztató engedélyezésének dátuma: 2024.03.01.
