KOGENATE BAYER 500 NE por és oldószer oldatos injekcióhoz
Hatóanyag:
octocog alfa
Csak vényre kapható
Kiszerelés:
1 poramp.+1 oldószeramp.+adagoló készlet

Tájékoztató ár:
-
Normatív TB-támogatás:
Nem
Eü. emelt támogatás:
Nem
-
Gyógyszerfőkategória:
K-VITAMIN ÉS EGYÉB VÉRZÉSCSILLAPÍTÓ SZEREK
-
Törzskönyvi szám:
EU/1/00/143/002
-
Gyógyszeralkategória:
Véralvadási faktorok
-
Gyártó:
Bayer Schering Pharma AG
Betegtájékoztató
1. MILYEN TÍPUSÚ GYÓGYSZER A KOGENATE Bayer 500 NE ÉS MILYEN BETEGSÉGEK ESETÉN ALKALMAZHATÓ?
A KOGENATE Bayer 500 NE a VIII-as véralvadási faktornak nevezett gyógyszercsoporthoz tartozik
(ATC-kód: B02B D02).
Vérzés kezelése vagy megelőzése "A" típusú hemofília (a VIII-as faktor veleszületett hiánya) esetén.
A készítmény nem tartalmaz von Willebrand-faktort, ezért von Willebrand-betegség esetén nem alkalmazható.
Egy injekcióhoz való port tartalmazó injekciós üveg névleges tartalma 500 NE (Nemzetközi Egység) alfa-oktokog. A megfelelő mennyiségű oldószerrel (injekcióhoz való víz) történő feloldás után az injekciós üveg 200 NE/ml oktocog alfát tartalmaz.
2. TUDNIVALÓK A KOGENATE Bayer 500 NE ALKALMAZÁSA ELŐTT
Ne alkalmazza a KOGENATE Bayer 500 NE készítményt, ha allergiás (túlérzékeny) az alfa- oktokogra, egér- vagy hörcsögfehérjére, vagy a KOGENATE Bayer 500 NE egyéb összetevőjére.
Ha nem biztos benne, kérdezze meg erről orvosát.
A KOGENATE Bayer 500 NE fokozott elővigyázatossággal alkalmazandó, mivel ritka esetekben anafilaktikus reakció (súlyos, hirtelen fellépő allergiás reakció) léphet fel. Ha mellkasi szorító érzést, szédülést tapasztal, rosszul érzi magát, hirtelen elgyengül vagy állva szédül, lehet, hogy allergiás a KOGENATE Bayer 500 NE készítményre. Ha eket a tüneteket észleli, azonnal hagyja abba a készítmény alkalmazását, és forduljon orvoshoz.
Előfordulhat, hogy orvosa vizsgálatokat tart szükségesnek annak megállapítására, hogy a KOGENATE Bayer 500 NE alkalmazott adagja elegendő-e a VIII. faktor megfelelő vérszintjének eléréséhez és fenntartásához.
Ha a vérzése a KOGENATE Bayer 500 NE készítménnyel nem szüntethető meg, azonnal forduljon orvoshoz. Előfordulhat, hogy a VIII. faktor hatását gátló anyagok (inhibitorok) alakultak ki, és orvosának ezt laboratóriumi vizsgálatokkal kell ellenőriznie. A VIII. faktor inhibitorai a vérben lévő ellenanyagok, amelyek gátolják az alkalmazott VIII. faktor hatását. Ezáltal a VIII. faktor kevésbé hatékonyan szünteti meg a vérzést.
Ha Önnél korábban VIII. faktor inhibitor alakult ki, és más VIII. faktor készítményre vált, akkor fennáll a kockázata annak, hogy ez az inhibitor ismét megjelenik.
A kezelés ideje alatt alkalmazott egyéb gyógyszerek
Bár más gyógyszerkészítménnyel való kölcsönhatás nem ismert, feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.
Terhesség és szoptatás
Az A-típusú hemofília nőknél ritka előfordulása következtében a KOGENATE Bayer terhesség és szoptatás alatti használatával kapcsolatban nincsenek tapasztalatok. Ezért a készítmény terhesség és szoptatás alatti alkalmazása előtt tanácsért forduljon orvosához.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
A készítménynek a gépjárművezetéshez és gépek k szükséges képességeket befolyásoló hatását nem észlelték.
Fontos információk a KOGENATE Bayer 500 NE egyes összetevőiről
A készítmény kevesebb mint 1 mmol (23 mg) nátriumot tartalmaz injekciós üvegenként, azaz gyakorlatilag nátriummentes.
3. HOGYAN KELL ALKALMAZNI A KOGENATE Bayer 500 NE KÉSZÍTMÉNYT?
A KOGENATE Bayer 500 NE készítményt csak intravénásan (vénába) szabad beadni, és feloldás után azonnal fel kell használni. A feloldás és alkalmazás során aszeptikus (tiszta és csíramentes) környezetre van szükség. Csak a készítményhez mellékelt orvosi eszközöket használja a KOGENATE Bayer 500 NE feloldásához és alkalmazásához. A KOGENATE Bayer 500 NE készítmény nem keverhető más infúziós oldattal. Kövesse az orvos utasításait és útmutatóként használja az alábbiakat:
1. Szappannal és meleg vízzel alaposan mosson kezet.
2. Mindkét bontatlan injekciós üveget melegítse a tenyerében kellemes (37 C - nál nem magasabb) hőmérsékletre.
3. Távolítsa el az injekciós üvegek védőkupakját. Ezután tisztítsa meg a gumidugókat egy steril törlőkendővel (A) (vagy használjon fertőtlenítő spray-t).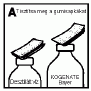
4. Az injekcióhoz való vizet tartalmazó injekciós üveget helyezze állítva egy szilárd, tiszta felületre és csatlakoztassa az áttöltő eszközt (B) úgy, hogy annak hullámos széle az injekciós üveg (C) felé nézzen. Az áttöltő eszközt függőlegesen tartva nyomja rá az injekciós üveg közepére. Ne csavarja az áttöltő eszközt a vizet tartalmazó injekciós üvegre.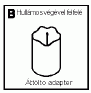
5. Helyezze a port tartalmazó injekciós üveget egy szilárd, tiszta felületre.
Fordítsa meg a vizet tartalmazó injekciós üveget a ráhelyezett áttöltő eszközzel együtt, és illessze rá függőlegesen a port tartalmazó injekciós üveg közepére és azonnal nyomja rá. Ne csavarja az áttöltő eszközt a port tartalmazó injekciós üvegre (D). Szorítsa össze a három elemet, és várja meg amíg a víz a vákuum hatására átkerül a port tartalmazó injekciós üvegbe.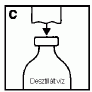
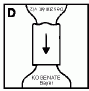
6. Távolítsa el és dobja el a injekcióhoz való vizet tartalmazó injekciós üveget és az áttöltő eszközt.
7. Lassan forgassa az injekciós üveget amíg miden anyag fel nem oldódott (E). Az injekciós üveget ne rázza. Ellenőrizze, hogy a por teljesen feloldódott-e. Ne használja fel a látható részecskéket tartalmazó vagy zavaros oldatot.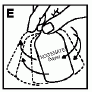
8. Illessze a szűrővel ellátott injekcióstűt a fecskendőbe (F). Húzza vissza a fecskendő dugattyúját a 3 ml-es jelig. A dugót átszúrva illessze a tűt az oldatot tartalmazó injekciós üvegbe, és tolja a dugattyút előre ütközésig, hogy levegőt juttasson az injekciós üvegbe.
9. A szűrővel ellátott injekcióstű és a fecskendő felett fogja meg az injekciós üveget (G). A dugattyú lassú, egyenletes kihúzásával töltse meg a fecskendőt. Ügyeljen arra, hogy az injekciós üveg teljes tartalma átkerüljön a fecskendőbe.
10. Tekerjen a karja köré érszorító gumit.
11. Döntse el, hova adja be az injekciót, és fertőtlenítse le a szúrás helyét.
12. Szúrja át a vénát és rögzítse a vénapunkcióra szolgáló készletet ragtapasszal.
13. A dugattyút mozdulatlanul tartva távolítsa el a fecskendőt a szűrővel ellátott injekcióstűről (az maradjon az injekciós üveghez csatlakozva). Csatlakoztassa a fecskendőt a vénapunkcióra szolgáló készlethez ügyelve arra, hogy ne kerüljön vér a fecskendőbe.
14. Távolítsa el az érszorító gumit.
15. Néhány perc alatt fecskendezze be a vénájába az oldatot, közben figyelje a tű helyzetét. A beadás sebességét az Ön kényelme határozza meg (maximális infúziós sebesség: 2 ml/perc).
16. Ha újabb adag beadására van szükség, használjon egy új, a fent leírt módon feloldott készítménnyel töltött fecskendőt.
17. Ha újabb adag beadása nem szükséges, távolítsa el a vénapunkcióra szolgáló készletet és a fecskendőt. Nyújtott karján körülbelül 2 percig szorítson egy törlőkendő géz- vagy vattagombócot az injekció helyére. Végül helyezzen kis szorítókötést a sebre.
A KOGENATE Bayer 500 NE alkalmazott mennyiségét és adagolási gyakoriságát több tényező befolyásolja, pl. a testtömeg, a hemofília súlyossága, a vérzés helye és mértéke, az inhibitorok mennyisége és az elérni kívánt VIII. faktor szint.
Orvosa kiszámítja a KOGENATE Bayer 500 NE adagját és azt, hogy milyen gyakran kell alkalmaznia, hogy elérje a szükséges VIII. faktor aktivitási szintet a vérében. Orvosa ezt egyéni szükségletei szerint, az alábbi képletek alapján számítja ki.
I. Szükséges NE = testtömeg (kg) x kívánt VIII. faktor emelkedés (a normál szint%-ában) x 0,5
II. Várt VIII. faktor emelkedés (a normál szint%-ában) = 2 x az alkalmazott NE
testtömeg (kg)
Az alábbi táblázat a VIII. faktor minimális vérszintjéről tájékoztat. A felsorolt, vérzéssel járó események során a VIII. faktor aktivitása nem lehet alacsonyabb a megadott szintnél (a normál szint%-ában):
A KOGENATE Bayer 500 NE készítmény alkalmazott mennyiségét és adagolási gyakoriságát orvosa mindig az Ön egyéni esetében fennálló klinikai hatékonyságtól függően határozza meg. Bizonyos körülmények között a számítottnál nagyobb adagra lehet szükség, különösen az első adag esetében.
Ha a KOGENATE Bayer 500 NE készítményt a vérzés megelőzésére használja (profilaxis), orvosa kiszámítja az Önnek megfelelő adagot. Ez általában testtömeg-kilogrammonként 20-60 NE alfa- oktokog, 2-3 napos időközönként alkalmazva. Azonban egyes esetekben, különösen fiatal betegeknél, rövidebb adagolási időközök vagy magasabb adagok válhatnak szükségessé.
Bár az adag a fenti számítások alapján megbecsülhető, hangsúlyozottan ajánlott a plazma megfelelő időközönkénti laboratóriumi vizsgálatának elvégzése annak ellenőrzésére, hogy sikerült-e elérni és fenntartani a szükséges VIII. faktor aktivitási szintet. Különösen nagyobb sebészeti beavatkozás esetén elengedhetetlen a faktorpótló terápia véralvadási vizsgálattal történő pontos monitorozása.
Amennyiben a VIII. faktor várt aktivitási szintjét a plazmában nem sikerül elérni, vagy ha a vérzés a nyilvánvalóan megfelelő adaggal nem állítható el, gyanítható, hogy a vérében VIII. faktor inhibitor van jelen. Megfelelő laboratóriumi eljárásokkal ellenőrizni kell a VIII. faktor inhibitorok jelenlétét, és egy abban jártas szakembernek meg kell határoznia annak mennyiségét.
Ha a KOGENATE Bayer 500 NE alkalmazása során annak hatását túlzottan erősnek, vagy csekélynek érzi, forduljon orvosához vagy gyógyszerészéhez.
Inhibitorok jelenléte
Ha orvosa arról tájékoztatta, hogy vérében VIII. faktor inhibitorok fejlődtek ki, akkor valószínű, hogy a korábbihoz képest nagyobb mennyiségű KOGENATE Bayer készítményt kell használnia a vérzés csillapítására. Amennyiben ez az adag nem szünteti hatásosan a vérzést, orvosa a kezelést kiegészítő készítmény - VIIa faktor koncentrátum vagy (aktivált) protrombin komplex koncentrátum -alkalmazása mellett dönthet. Az orvosával történő egyeztetés nélkül ne növelje a vérzés csillapítására használt KOGENATE Bayer adagját. További információért forduljon orvosához.
Az ilyen kezeléseket az A-típusú haemophilia kezelésében tapasztalt orvos irányítása mellett kell végezni.
A KOGENATE Bayer 250 NE készítményt intravénásan kell beadni több perces időtartam alatt. A beadás sebességét a beteg komfort-érzése határozza meg (maximális infúziós sebesség: 2 ml/perc).
Orvosa megmondja Önnek, hogy a KOGENATE Bayer 500 NE készítményt milyen gyakran, milyen időközönként kell használnia.
A KOGENATE Bayer 500 NE készítménnyel végzett faktorpótló terápia általában élethosszig tart.
Ha az előírtnál több KOGENATE Bayer 500 NE készítményt alkalmazott
A rekombináns VIII. véralvadási faktor túladagolásával kapcsolatos tünetekről nem számoltak be.
Ha az előírtnál több KOGENATE Bayer 500 NE készítményt alkalmazott, értesítse kezelőorvosát.
Ha elfelejtette alkalmazni a KOGENATE Bayer 500 NE készítményt
- Azonnal folytassa a következő adaggal, és a továbbiakban alkalmazza az orvosa által meghatározott szabályos időközönként.
- Ne alkalmazzon kétszeres adagot a kihagyott adag pótlására.
Ha idő előtt abbahagyja a KOGENATE Bayer 500 NE alkalmazását
Ne hagyja abba a KOGENATE Bayer 500 NE alkalmazását orvosa megkérdezése nélkül.
Ha bármilyen további kérdése van a készítmény alkalmazásával kapcsolatban, kérdezze meg orvosát vagy gyógyszerészét.
4. LEHETSÉGES MELLÉKHATÁSOK
Mint minden gyógyszer, így a KOGENATE Bayer 500 NE készítmény is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Az alábbiakban felsorolt lehetséges mellékhatások gyakoriságát a következő osztályozás szerint adjuk meg:
nagyon gyakori (10 betegből több mint 1 esetben jelentkezik)
gyakori (100 betegből 1-10 esetben jelentkezik)
nem gyakori (1000 betegből 1-10 esetben jelentkezik)
ritka (10 000 betegből 1-10 esetben jelentkezik)
nagyon ritka (10 000 betegből kevesebb mint 1 esetben jelentkezik)
nem ismert (gyakorisága a rendelkezésre álló adatokból nem állapítható meg).
Gyakori mellékhatások:
A következő mellékhatások bármelyike jelentkezhet a KOGENATE Bayer 500 NE alkalmazása után:
- kiütés/viszkető kiütés
- helyi reakciók az injekció beadásának helyén (pl. égető érzés, átmeneti bőrpír)
Ritka mellékhatások:
A következő mellékhatások bármelyike jelentkezhet a KOGENATE Bayer 500 NE alkalmazása után:
- túlérzékenységi reakciók (pl. mellkasi szorító érzés/általános rossz közérzet, szédülés és émelygés, valamint enyhe vérnyomáscsökkenés, ami miatt álló helyzetben ájulásközeli érzést tapasztalhat),
- láz.
Ezen kívül nem zárható ki teljesen az anafilaxiás reakció lehetősége. Amennyiben injekció/infúzió közben az alábbi tünetek bármelyikét tapasztalja:
- mellkasi szorító érzés/általános rossz közérzet,
- szédülés,
- enyhe vérnyomáscsökkenés (amely miatt álló helyzetben ájulásközeli érzést tapasztalhat),
- émelygés,
az túlérzékenység vagy anafilaktikus reakciót előjele lehet. Ha allergiás vagy anafilaktikus reakciók lépnek fel, azonnal szüntesse meg az injekció vagy infúzió adását. Azonnal forduljon orvoshoz.
A vizsgálatok során egy betegnél sem jelent meg klinikailag jelentős mennyiségű ellenanyag a készítményben nyomokban jelen levő egér- és hörcsögfehérjével szemben. Az összetevőkkel, pl. a készítményben nyomokban jelen levő egér- és hörcsögfehérjével szembeni allergiás reakció lehetősége azonban az erre hajlamos betegek esetében fennáll.
Az A-típusú hemofíliában szenvedők kezelésének ismert szövődménye a VIII. faktort semlegesítő ellenanyagok (inhibitorok) kialakulása. A rekombináns VIII. faktorkészítményekkel végzett vizsgálatok során elsősorban a korábban nem kezelt hemofíliás betegeknél figyelték meg az inhibitorok kialakulását.
Állapota klinikai megfigyelésével és laboratóriumi vizsgálatokkal gondosan ellenőrizni kell Önnél az inhibitorok esetleges megjelenését.
Klinikai vizsgálatokban a KOGENATE Bayer készítményt vérzéseses epizódok kezelésére alkalmazták 37, korábban nem kezelt betegnél, és 23, minimális mértékben (ami a meghatározás szerint 4 vagy annál kevesebb kezelési napot jelent) kezelt gyermekbetegnél. A KOGENATE Bayer készítménnyel kezelt 37, korábban nem kezelt betegből 5 (14%), a 23, minimális mértékben kezelt gyermekbetegből pedig 4 (17%) esetében termelődött inhibitor: összességében, 60 betegből 6 esetében (10%) volt a titer 10 BU felett, és 60-ból 3 esetben (5%) 10 BU alatt. Ezeknél a betegeknél az inhibitor észlelésének időpontjában a kezelési idő középértéke 9 nap volt (tartomány: 3-18 nap).
A klinikai vizsgálatokban a kezelési idő középértéke 114 nap volt (tartomány: 4-478). Azon 5 betegből, akik a vizsgálat végére nem érték el a 20 napos kezelési időt, végül 4 beteg - a vizsgálat utáni követéses vizsgálatban - több mint 20 napos kezelési időt ért el, és egyikükben alacsony titerű inhibitor termelődött. A ötödik beteg követése megszakadt.
A 73, korábban már (a meghatározás szerint 100 napot meghaladó időszakon át) kezelt beteggel végzett négyéves követéses klinikai vizsgálatokban nem észleltek de-novo termelődő inhibitorokat.
A KOGENATE Bayer készítménnyel - a törzskönyvezést követően több mint 1000 beteg bevonásával - végzett kiterjedt vizsgálatokban a következő megfigyelést tették: A korábban már kezelt betegek kevesebb mint 0,2%-ában termelődtek de-novo inhibitorok. A vizsgálatba lépéskor 20 kezelési napnál kevesebbel rendelkezők alcsoportjában a résztvevők kevesebb mint 11%-ában termelődtek de-novo inhibitorok.
Ha bármely mellékhatás súlyossá válik, vagy ha a betegtájékoztatóban felsorolt mellékhatásokon kívül egyéb tünetet észlel, kérjük, értesítse orvosát vagy gyógyszerészét.
5. HOGYAN KELL A KOGENATE Bayer 500 NE KÉSZÍTMÉNYT TÁROLNI?
A gyógyszer gyermekektől elzárva tartandó!
Hűtőszekrényben (2 °C - 8 °C) tárolandó. Nem fagyasztható! A fénytől való védelem érdekében az injekciós üveget tartsa a dobozban.
A külső csomagolásban tárolt készítmény szobahőmérsékleten (legfeljebb 25 C) 3 hónapig tárolható. Ebben az esetben a 3 hónap leteltekor a készítmény felhasználhatósági időtartama véget ér. Az új lejárati dátumot fel kell tüntetni a külső csomagolás tetején.
Feloldás után hűtőszekrényben nem tárolható. A feloldott készítményt azonnal fel kell használni. A készítmény egy alkalommal használható fel. A fel nem használt oldat hulladékként kezelendő.
A csomagoláson és a címkén feltüntetett lejárati idő (Felhasználható:) után ne alkalmazza a KOGENATE Bayer 500 NE készítményt. A lejárati idő a megadott hónap utolsó napjára vonatkozik.
Ne alkalmazza a KOGENATE Bayer 500 NE készítményt, ha látható részecskéket tartalmaz vagy zavaros.
6. TOVÁBBI INFORMÁCIÓK
Mit tartalmaz a KOGENATE Bayer 500 NE készítmény
Por:
A készítmény hatóanyaga a rekombináns VIII. véralvadási faktor (alfa-oktokog).
Egyéb összetevők: glicin, nátrium-klorid, kalcium-klorid, hisztidin, poliszorbát 80 és szacharóz.
Oldószer:
Injekcióhoz való víz.
Milyen a KOGENATE Bayer 500 NE készítmény külleme és mit tartalmaz a csomagolás
A KOGENATE Bayer 500 NE készítmény kiszerelése: fehér vagy enyhén sárga színű por vagy pogácsa és oldószer oldatos injekcióhoz. Feloldás után az oldat tiszta. A KOGENATE Bayer 500 NE minden egyes csomagja tartalmazza a feloldáshoz és beadáshoz szükséges orvosi eszközöket.
A szöveg publikálásának dátuma az ema.europa.eu weboldalon: 2009.11.12.
