GANIRELIX GEDEON RICHTER 0,25 mg/0,5 ml oldatos injekció előretöltött fecskendőben
Hatóanyag:
ganirelix
Csak vényre kapható
Kiszerelés:
1x előretöltött fecskendőben

Tájékoztató ár:
-
Normatív TB-támogatás:
Nem
Eü. emelt támogatás:
Nem
-
Gyógyszerfőkategória:
HYPOTHALAMUS HORMONOK
-
Törzskönyvi szám:
EU/1/22/1658/001
-
Gyógyszeralkategória:
Antigonadotropin-releasing hormonok
-
Gyártó:
Richter Gedeon
Betegtájékoztató
1. Milyen típusú gyógyszer a Ganirelix Gedeon Richter és milyen betegségek esetén alkalmazható?
A Ganirelix Gedeon Richter hatóanyaga a ganirelix, és az úgynevezett gonadotropinfelszabadító- hormon-elleni gyógyszerek csoportjába tartozik, melyek gátolják a természetes gonadotropin felszabadító hormon (GnRH) hatásait. A GnRH a gonadotropinok (sárgatestképződést segítő hormon (luteinizáló hormon -LH) és a follikulus stimuláló hormon (FSH)) felszabadulását szabályozza.
A gonadotropinok fontos szerepet játszanak az emberi termékenységben és szaporodásban. Nőknél az FSH a petefészkekben a tüszők növekedéséhez és fejlődéséhez szükséges. A tüszők kicsiny gömbölyű zsákocskák, amelyek a petesejteket tartalmazzák. Az LH az érett petesejteknek a tüszőkből és a petefészkekből történő kiszabadulásához (ovuláció) szükséges. A Ganirelix Gedeon Richter gátolja a GnRH hatását, ami különösen az LH felszabadulásának gátlását eredményezi.
A Ganirelix Gedeon Richter alkalmazható
Mesterséges megtermékenyítési eljárásban részesült nőknél, beleértve az in vitro megtermékenyítést (IVF) és más módszereket, esetenként előfordulhat túl korai peteérés, amely jelentősen csökkenti a teherbeesés esélyét. A Ganirelix Gedeon Richter az idő előtti petesejt kiszabadulását okozó korai LH- kiáramlás megelőzésére alkalmazzák.
A klinikai vizsgálatokban a ganirelixet rekombináns tüszőérést serkentő hormonnal (follikulus stimuláló hormon - FSH) vagy a tartós hatású follikulus stimuláló korifollitropin alfával együtt alkalmazták.
2. Tudnivalók a Ganirelix Gedeon Richter alkalmazása előtt
Ne alkalmazza a Ganirelix Gedeon Richter-t
- ha allergiás a ganirelixra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére;
- ha Ön túlérzékeny gonadotropin felszabadító hormonnal (GnRH) vagy valamely GnRH-analóggal szemben;
- ha Ön közepesen súlyos vagy súlyos vese- vagy májbetegségben szenved;
- ha Ön terhes vagy szoptat.
Figyelmeztetések és óvintézkedések
A Ganirelix Gedeon Richter alkalmazása előtt beszéljen kezelőorvosával, gyógyszerészével vagy a gondozását végző egészségügyi szakemberrel.
Allergiás reakciók
Ha Ön aktív allergiás megbetegedésben szenved, kérjük, tájékoztassa kezelőorvosát. Kezelőorvosa fogja az Ön állapotának súlyossága függvényében eldönteni, hogy a kezelés során szükség van-e további ellenőrzésre. Allergiás reakciókat jelentettek már az első dózis beadását követően.
Általános és helyi túlérzékenységi reakciókat jelentettek, beleértve a csalánkiütést (urtikária), az arc, ajkak, nyelv és/vagy a torok duzzanata, amelyek nehézlégzést és/vagy nyelési nehézséget okozhatnak (angioödéma és/vagy anafilaxia). (Lásd 4 pontot is.) Ha Önnél allergiás reakció jelentkezik, hagyja abba a Ganirelix Gedeon Richter alkalmazását, és sürgősen kérjen orvosi segítséget.
Ovárium hiperstimulációs szindróma (OHSS)
A petefészkek hormonális stimulációja során vagy azt követően a petefészkek hiperstimulációs szindrómája alakulhat ki. Ez a szindróma a gonadotropinokkal történő stimulációs eljárással függ össze. Ellenőrizze az Önnek felírt gonadotropin-tartalmú gyógyszerek betegtájékoztatóját.
Ikerszülések vagy veleszületett rendellenességek
A veleszületett rendellenességek előfordulása asszisztált reprodukciós kezelés után enyhén emelkedettebb lehet, mint spontán fogamzás esetén. Ez az enyhe növekedés vélhetően kapcsolatban van a meddőségi kezelésben részt vevők jellemzőjével (például a nő életkora, a hímivarsejtek jellemzői) és az asszisztált reprodukciós kezeléseket követő többszörös terhességekkel. A veleszületett rendellenességek előfordulása ganirelix-szel történő reprodukciós kezelések után nem különbözik más GnRH-analógokkal történő reprodukciós kezelésekétől.
Terhességi komplikációk
Petevezeték-károsodás esetén enyhén emelkedett a méhen kívül létrejött terhesség (méhen kívüli terhesség) kockázata.
50 kg-nál kisebb és 90 kg-nál nagyobb testtömegű nők
A ganirelix hatásosságát és biztonságosságát 50 kg-nál kisebb és 90 kg-nál nagyobb testtömegű nőknél nem igazolták. További információért kérdezze kezelőorvosát.
Gyermekek és serdülők
A Ganirelix Gedeon Richter-nek gyermekek és serdülők esetén nincs releváns alkalmazása.
Egyéb gyógyszerek és a Ganirelix Gedeon Richter
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
Terhesség, szoptatás és termékenység
A Ganirelix Gedeon Richter asszisztált reprodukciós technikák (ART) keretében végzett kontrollált ovariális hiperstimuláció során alkalmazandó.
Ne alkalmazzon Ganirelix Gedeon Richter-t terhesség és szoptatás alatt.
A gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A Ganirelix Gedeon Richter-nek a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket befolyásoló hatásait nem vizsgálták.
A Ganirelix Gedeon Richter nátriumot tartalmaz
A készítmény kevesebb mint 1 mmol (23 mg) nátriumot tartalmaz injekciónként, azaz gyakorlatilag "nátriummentes".
3. Hogyan kell alkalmazni a Ganirelix Gedeon Richter-t?
A gyógyszert mindig a kezelőorvosa vagy gyógyszerésze által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
A Ganirelix Gedeon Richter-t az asszisztált reprodukciós technikákban (ART) alkalmazott kezelés részeként használják, köztük in vitro fertilizáció (IVF) során.
A follikulus stimuláló hormonnal (FSH) vagy korifollitropinnal történő petefészek-stimuláció az Ön ciklusának 2. vagy 3. napján kezdődhet. A Ganirelix Gedeon Richter-t (0,25 mg) naponta egyszer kell beadni a bőr alatti zsírrétegbe, a stimuláció 5. vagy 6. napján kezdve. Az Ön petefészkeinek válaszreakciója alapján kezelőorvosa dönthet úgy, hogy a Ganirelix Gedeon Richter-t egy másik napon kezdi.
A Ganirelix Gedeon Richter-t és az FSH-t körülbelül ugyanabban az időben kell beadni. A készítményeket azonban nem szabad keverni, és különböző helyekre kell az injekciót beadni.
A Ganirelix Gedeon Richter-rel történő napi kezelést addig kell folytatni, amíg megfelelő méretű tüszőből elegendő áll rendelkezésre. A petesejtek végső érését a tüszőkben humán koriogonadotropin (hCG) adásával lehet kiváltani.
Két Ganirelix Gedeon Richter közötti, valamint az utolsó Ganirelix Gedeon Richter és a hCG injekció közötti időtartam nem haladhatja meg a 30 órát, különben idő előtti peteérés (ovuláció), azaz a petesejt kiszabadulása következhet be. Éppen ezért délelőtt adott Ganirelix Gedeon Richter-rel történő kezelés során a Ganirelix Gedeon Richter-kezelést az egész gonadotropin-kezelési periódus során alkalmazni kell, beleértve a peteérés kiváltásának napját is. Délután történő Ganirelix Gedeon Richter adás esetén az utolsó Ganirelix Gedeon Richter-t a peteérés kiváltását megelőző napon, délután kell adni.
Használati utasítás
A gyógyszer beadása előtt nagyon fontos, hogy Ön figyelmesen olvassa el és szorosan kövesse a betegtájékoztató végén található részletes használati utasítást.
Az injekció beadási helye
A Ganirelix Gedeon Richter előretöltött fecskendők formájában kerül kiszerelésre, és lassan kell beadni a bőr alatti zsírrétegbe, lehetőleg a combba. Felhasználás előtt vizsgálja meg az oldatot! Ne használja az oldatot, amennyiben részecskéket tartalmaz, vagy nem tiszta! Láthat légbuboréko(ka)t az előretöltött fecskendőben. Ez normális jelenség, és a légbuborék(ok) eltávolítása nem szükséges. Ha saját magának adja be az injekciót, vagy a beadást partnere végzi, kövesse gondosan az utasításokat! Ne keverje a Ganirelix Gedeon Richter-t semmilyen más gyógyszerrel!
Az injekció beadási helyének előkészítése
Szappannal és vízzel gondosan mosson kezet. Fertőtlenítőszerrel (például alkohollal) tisztítsa meg az injekció beadásának helyét, hogy a felszíni baktériumokat eltávolítsa. A tű beszúrásának helye körül legalább 5 cm-es területet tisztítson meg, és legalább egy percig hagyja száradnia fertőtlenítőszert.
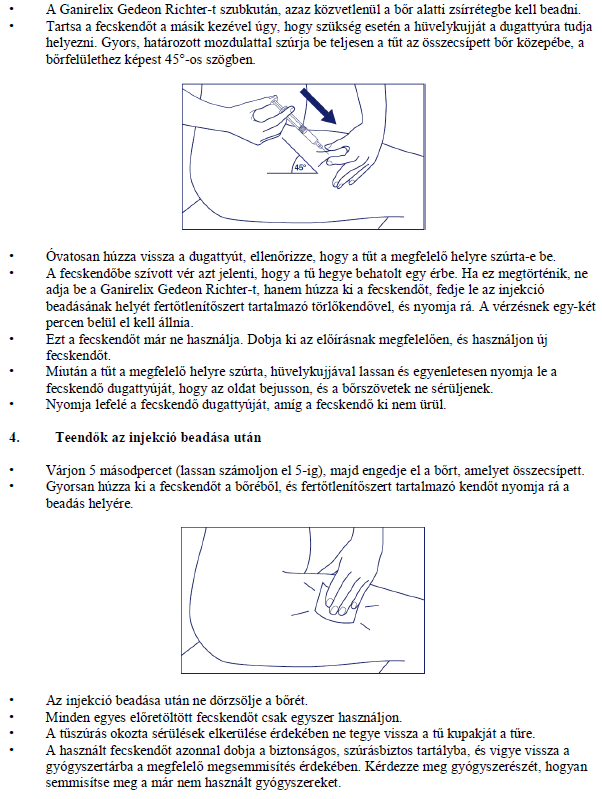
A tű beszúrása
Távolítsa el a tű védőkupakját. Mutató- és hüvelykujjával csippentsen össze egy nagyobb bőrterületet.
Szúrja be a tűt az összecsípett bőr alapjánál, a bőrfelszínre 45 fokos szögben. Minden egyes injekciót különböző helyre adjon be.
A tű megfelelő helyzetének ellenőrzése
Óvatosan húzza vissza a fecskendő dugattyúját annak érdekében, hogy ellenőrizze, a tű jó helyzetben van-e. Ha vér jut a fecskendőbe, az arra utal, hogy a tű hegye eret ért. Ilyenkor ne adja be a Ganirelix Gedeon Richter-t, hanem távolítsa el a fecskendőt, fedje le az injekciós területet fertőtlenítőszert tartalmazó gézzel, és nyomja oda; a vérzés egy-két percen belül eláll. Ne használja ezt a fecskendőt, megfelelő módon semmisítse meg. Kezdje újra egy újabb fecskendővel.
Az oldat befecskendezése
Ha sikerült a tűt megfelelő helyen beszúrni, lassan és folyamatosan nyomja be a dugattyúját, hogy az oldatot megfelelően fecskendezze be és a bőr szövetei ne károsodjanak. A dugattyút mindaddig tartsa benyomva, amíg a fecskendő ki nem ürül, majd várjon még 5 másodpercig.
A fecskendő eltávolítása
Húzza ki gyorsan a fecskendőt, és egy fertőtlenítőszert tartalmazó gézt nyomjon az injekciós helyre! Az előretöltött fecskendőt csak egyszer használja!
Ha az előírtnál több Ganirelix Gedeon Richter-t alkalmazott
Keresse fel kezelőorvosát!
Ha elfelejtette alkalmazni a Ganirelix Gedeon Richter-t
Amennyiben észrevette, hogy elfelejtett egy adagot beadni, adja be a lehető leghamarabb. Ne alkalmazzon kétszeres adagot a kihagyott adag pótlására.
Ha több mint hat órát késik (azaz a két injekció között eltelt idő több mint harminc óra), adja be az adagot a lehető leghamarabb, és további tanácsért forduljon kezelőorvosához.
Ha idő előtt abbahagyja a Ganirelix Gedeon Richter alkalmazását
Ne hagyja abba a Ganirelix Gedeon Richter alkalmazását, csak akkor, ha azt kezelőorvosa tanácsolta, mivel ez befolyásolhatja az Ön kezelésének kimenetelét.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A mellékhatások kialakulásának esélyét a következő kategóriák írják le:
Nagyon gyakori (10 nőből több mint 1-et érinthet)
- Helyi bőrreakciók az injekció beadásának helyén (főleg bőrpír, duzzanattal vagy anélkül). A helyi reakció normálisan a beadástól számított négy órán belül megszűnik.
Nem gyakori (100 nőből legfeljebb 1-et érinthet)
- Fejfájás.
- Hányinger.
- Általános rossz közérzet.
Nagyon ritka (10000 nőből legfeljebb 1-et érinthet)
- Allergiás reakciókat észleltek már az első adag beadását követően.
-- Bőrkiütés.
-- Az arc duzzanata.
-- Nehézlégzés (diszpnoé).
-- Az arc, ajkak, nyelv, és/vagy torok duzzanata, amely nehézlégzést és/vagy nyelési nehézséget okozhat (angioödéma és/vagy anafilaxia).
-- Csalákiütés (urtikária).
- Korábban már meglevő kiütés (ekcéma) rosszabbodását észlelték egy betegnél az első ganirelix adagot követően.
Ezen túlmenően beszámoltak olyan mellékhatásokról, amelyekről ismeretes, hogy ellenőrzött petefészek hiperstimulációs kezelés során fellépnek (például hasi fájdalom, petefészek hiperstimulációs szindróma (OHSS), méhen kívüli terhesség (amikor a magzat a méhen kívül fejlődik) és vetélés (lásd az Önnél alkalmazott FSH-t tartalmazó készítmény betegtájékoztatóját)).
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül: Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet, Postafiók 450, H-1372 Budapest, Magyarország, honlap: https://mellekhatas.ogyei.gov.hu/
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Ganirelix Gedeon Richter-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A dobozon és a címkén feltüntetett lejárati idő ("EXP") után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Nem fagyasztható!
A fénytől való védelem érdekében az eredeti csomagolásban tárolandó.
Használat előtt vizsgálja meg a fecskendőt! Kizárólag tiszta, részecskéktől mentes oldatot tartalmazó, és ép csomagolásból származó fecskendőt használjon!
Minden előretöltött fecskendő csak egy injekció beadására szolgál.
A gyógyszer beadásához alkoholos törlőkendőre, gézlapokra és éles eszközök tárolására való tartályra van szükség, de ezeket nem tartalmazza a csomagolás.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Ganirelix Gedeon Richter?
- A készítmény hatóanyaga a ganirelix (0,25 mg 0,5 ml oldatban).
- Egyéb összetevők: tömény ecetsav, mannit (E 421), injekcióhoz való víz. A pH (a kémhatás mérésére szolgál) beállítása nátrium-hidroxiddal és ecetsavval történhet (lásd 2. pont "A Ganirelix Gedeon Richter nátriumot tartalmaz").
Milyen a Ganirelix Gedeon Richter külleme és mit tartalmaz a csomagolás?
A Ganirelix Gedeon Richter tiszta, színtelen oldat injekcióhoz. A gyógyszer egy üvegfecskendőbe van töltve, egy rozsdamentes acél tűvel, dugattyúdugóval lezárva és dugattyúrúddal ellátva. Az injekciós tű merev tűvédővel van ellátva.
A Ganirelix Gedeon Richter 1 előretöltött fecskendőt vagy 6 előretöltött fecskendőt tartalmazó csomagolásban kerül forgalomba.
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
Használati utasítás

A szöveg publikálásának dátuma az ema.europa.eu weboldalon: 2022.07.20.
