BEOVU 120 mg/ml oldatos injekció előretöltött fecskendőben
Hatóanyag:
brolucizumab
Csak vényre kapható
Kiszerelés:
1x

Tájékoztató ár:
-
Normatív TB-támogatás:
Nem
Eü. emelt támogatás:
Nem
-
Gyógyszerfőkategória:
SZEMÉSZETI ÉRBETEGSÉGEK SZEREI
-
Törzskönyvi szám:
EU/1/19/1417/001
-
Gyógyszeralkategória:
Érújraképződést gátló szerek
-
Gyártó:
Novartis Europharm
Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Ehhez Ön is hozzájárulhat a tudomására jutó bármilyen mellékhatás bejelentésével. A mellékhatások jelentésének módjairól a 4. pont végén (Mellékhatások bejelentése) talál további tájékoztatást.
Betegtájékoztató
1. Milyen típusú gyógyszer a Beovu és milyen betegségek esetén alkalmazható?
Milyen típusú gyógyszer a Beovu?
A Beovu hatóanyaga a brolucizumab, ami az érújdonképződés elleni szereknek nevezett gyógyszerek csoportjába tartozik. A Beovu-t kezelőorvosa injekciózza be a szembe olyan szembetegségek kezelése céljából, amelyek hatással lehetnek az Ön látására.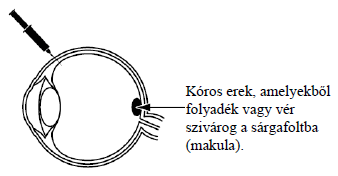
Milyen betegségek esetén alkalmazható a Beovu?
A Beovu-t olyan szembetegségek kezelésére alkalmazzák felnőtteknél, amelyek akkor alakulnak ki, amikor a sárgafolt alatt kóros erek képződnek és növekednek. A szemfenéken található sárgafolt felel az éles látásért. Ezekből a kóros erekből folyadék vagy vér szivároghat a szembe, és zavarhatja a sárgafolt működését, ami adott esetben csökkent látást okozó betegségeket okoz, mint például:
- nedves időskori makuladegeneráció (nedves AMD),
- diabéteszes makulaödéma (DMO).
Hogyan hat a Beovu?
A Beovu lelassíthatja a betegség romlását, és ennek következtében megőrzi vagy akár javítja is az Ön látását.
2. Tudnivalók a Beovu beadása előtt
Tilos Beovu-t adni Önnek:
- ha allergiás a brolucizumabra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
- ha aktív vagy feltételezett fertőzés van a szemében vagy körülötte.
- ha fáj vagy vörös a szeme (szemgyulladás).
Amennyiben ezek bármelyike érvényes Önre, mondja el kezelőorvosának. Nem szabad Beovu-t adni Önnek.
Figyelmeztetések és óvintézkedések
A Beovu beadása előtt beszéljen kezelőorvosával, ha az alábbiak bármelyike igaz Önre:
- ha Önnek zöldhályogja van (olyan szembetegség, amelyet rendszerint a szemen belüli magas nyomás okoz).
- ha az Ön kórelőzményében fényfelvillanások vagy lebegő homályok (sötét, lebegő pontok) látása szerepel, és ha Önnél hirtelen megnövekszik a lebegő homályok mérete és száma.
- ha Önnek szemműtéte volt az elmúlt 4 hétben, vagy ha szemműtétet terveznek Önnél a következő négy hétben.
- ha valaha volt szembetegsége vagy kapott szemészeti kezelést.
- ha az elmúlt egy évben előfordult Önnél hirtelen kialakuló látásvesztés, mely a szem hátsó részén található vérerek elzáródása (retinális érelzáródás) vagy a szem hátsó részén található vérerek gyulladása (retinális érgyulladás) miatt alakult ki.
Azonnal szóljon kezelőorvosának, ha:
- a szem kivörösödése, szemfájdalom, fokozott kellemetlen érzés, a szem kivörösödésének súlyosbodása, homályos vagy csökkent látás, a látóterében lévő kis részecskék növekvő száma, fokozott fényérzékenység alakul ki.
- hirtelen elveszíti a látását, ami egy szembeli ér elzáródását jelezheti.
Kezelőorvosa a fenti tünetek bármelyikének kialakulása esetén leállíthatja Önnél a Beovu-val végzett kezelést.
Fontos, még tudnia, hogy:
- a Beovu biztonságosságát és hatásosságát nem vizsgálták egyszerre mindkét szembe való beadás esetén, és az ilyen módon történő alkalmazás a mellékhatások kialakulásának nagyobb kockázatát okozhatja.
- a Beovu beadása egyes betegeknél növelheti a szemgolyón belüli nyomást (szembelnyomás) az injekció beadása utáni 30 percen belül. Kezelőorvosa minden injekció után figyelni fogja, nem alakul-e ki Önnél ez a jelenség.
- kezelőorvosa megvizsgálja, hogy fennállnak-e Önnél további kockázati tényezők, amelyek fokozhatják a szem hátsó részén található egyik hártya elszakadásának vagy leválásának veszélyét (retinaleválás vagy retinaszakadás, valamint a retinális festékhám leválása vagy szakadása); ilyen esetben a Beovu-t óvatosan kell beadni.
A VEGF-gátlók (a Beovu hatóanyagához hasonló szerek) szisztémás (a teljes szervezetet érintő) alkalmazása összefüggésben állhat annak kockázatával, hogy vérrögök zárják el a vérereket (artériás tromboembóliás események), ami szívrohamhoz vagy agyi érkatasztrófához (sztrók) vezethet.
Elméletileg lehetséges, hogy ilyen események következzenek be a Beovu szembe történő beadása után.
Gyermekek és serdülők
A Beovu-t nem alkalmazzák gyermekeknél és serdülőknél.
Egyéb gyógyszerek és a Beovu
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
Terhesség és szoptatás
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer beadása előtt beszéljen kezelőorvosával.
Nem javasolt a szoptatás a Beovu-kezelés alatt, és a Beovu-kezelés leállításakor legalább egy hónapig, mert nem ismert, hogy a Beovu átjut-e az emberi anyatejbe.
Azoknak a nőknek, akik teherbe eshetnek, hatékony fogamzásgátlást kell alkalmazniuk a kezelés alatt és a Beovu-kezelés leállítása után még legalább egy hónapig. Azonnal mondja el kezelőorvosának, ha a kezelés alatt teherbe esik, vagy azt gondolja, hogy terhes.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A Beovu injekció beadása után átmeneti látászavarok (például homályos látás) alakulhatnak ki Önnél. Ne vezessen gépjárművet vagy ne kezeljen gépeket, amíg ezek tartanak.
A Beovu nátriumot tartalmaz
A készítmény kevesebb mint 1 mmol (23 mg) nátriumot tartalmaz adagonként, azaz gyakorlatilag "nátriummentes".
3. Hogyan alkalmazzák a Beovu-t?
Mennyi Beovu-t kell adni, és milyen gyakran?
A javasolt adag 6 mg brolucizumab.
Nedves AMD
- Az első 3 hónapban havonta egy injekciót fog kapni.
- Ezt követően egy injekciót kaphat 3 havonta. Kezelőorvosa a szeme állapota alapján meg fogja határozni, hogy milyen gyakran kapja a kezelést. Bizonyos betegeknek 2 havonta lehet szüksége kezelésre. A Beovu két adagjának alkalmazása között legalább 2 hónapnak kell eltelnie.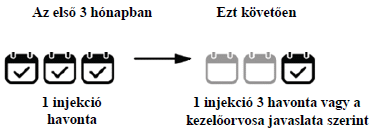
DMO
- Az első öt injekciót hat hetes időközönként, egyesével adják be Önnek.
- Azt követően lehetséges, hogy 3 havonként fog egy injekciót kapni. A kezelés gyakoriságát kezelőorvosa állapítja meg a szem állapota alapján; vannak olyan betegek, akik számára 2 havonkénti kezelés szükséges.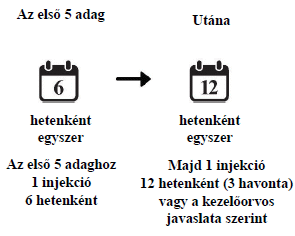
Az alkalmazás módja
A Beovu-t injekció formájában adja be az Ön szemébe (intravitreálisan alkalmazva) egy szemész orvos.
A fertőzés megelőzése érdekében az injekció előtt kezelőorvosa gondosan kimossa a szemét. Kezelőorvosa szemcseppet (helyi érzéstelenítőt) is fog adni, hogy érzéstelenítse a szemét, és csökkentse vagy megelőzze az injekció beadásával járó fájdalmat.
Mennyi ideig tart a Beovu-kezelés?
A Beovu idült szembetegségek kezelésére szolgál, amelyek hosszan tartó kezelést igényelnek, ami hónapokig vagy évekig folytatódhat. Kezelőorvosa a rendszeres, tervezett kontrollvizsgálatok alkalmával ellenőrizni fogja, hogy a kezelés hatásos-e. Kezelőorvosa két injekció beadása között is ellenőrizheti a szemeit. Ha kérdése van azzal kapcsolatosan, hogy mennyi ideig fogja kapni a Beovu-t, beszéljen kezelőorvosával.
A Beovu-kezelés leállítása előtt
A kezelés leállítása előtt beszéljen kezelőorvosával. A kezelés leállítása növelheti a látásvesztés kockázatát, és romolhat a látása.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek. A Beovu injekcióval járó mellékhatásokat maga a gyógyszer vagy az injekciós eljárás okozza, és ezek főként a szemet érintik.
Egyes mellékhatások súlyosak lehetnek
Azonnal szerezzen orvosi segítséget, ha az alábbiak alakulnak ki, amelyek allergiás reakciók, gyulladások vagy fertőzések jelei lehetnek:
- a látás hirtelen kialakuló romlása vagy megváltozása,
- fájdalom, fokozott kellemetlen érzés, a szem kivörösödésének súlyosbodása. Ha Önnél bármilyen súlyos mellékhatás alakul ki, azonnal szóljon kezelőorvosának.
További, lehetséges mellékhatások
A Beovu-kezelés után esetleg jelentkező egyéb mellékhatások közé az alább felsoroltak tartoznak:
A mellékhatások többsége enyhe-közepesen súlyos, és általában minden injekció után legfeljebb egy héttel elmúlnak majd.
Ha ezeknek a mellékhatásoknak bármelyike súlyossá válik, kérjük, szóljon kezelőorvosának.
Gyakori: 10 betegből legfeljebb 1 beteget érinthet
- a szem középső rétegének gyulladása (uveitisz),
- a szem belsejében lévő kocsonyás anyag leválása (üvegtesti leválás),
- a retina (a szemfenék fényérzékelő része) vagy egy rétegének szakadása (a retinális pigmenthám szakadása),
- csökkent látásélesség,
- vérzés az ideghártyán (retinális vérzés),
- a szivárványhártya, vagyis a szem színes részének gyulladása (iritisz),
- a szemlencse elhomályosodása (szürkehályog),
- a szem külső rétegében lévő erekből kialakuló vérzés (kötőhártya-bevérzés),
- mozgó pontok a látóterében (úszó üvegtesti homályok),
- szemfájdalom,
- megnövekedett nyomás a szemen belül,
- a szemfehérje vörössége (kötőhártyagyulladás),
- homályos vagy nem tiszta látás,
- a szaruhártya horzsolása, a szem szivárványhártyát borító, átlátszó rétegének a sérülése,
- a szem szivárványhártyát borító, átlátszó rétegének a károsodása (keratitisz punktáta),
- allergiás reakció (túlérzékenység).
Nem gyakori: 100 betegből legfeljebb 1 beteget érinthet
- a szem belsejének súlyos gyulladása (endoftalmitisz),
- vakság,
- a szemben lévő egyik verőér elzáródása következtében hirtelen kialakuló látásvesztés (retinális artéria okklúzió),
- a szem ideghártyájának leválása (retinaleválás),
- a szem kivörösödése (kötőhártya-vérbőség),
- fokozott könnytermelés,
- szokatlan érzés a szemben,
- a szem ideghártyája (retina) egyik rétegének a leválása (retinális pigmenthám leválása),
- a szem belsejében lévő kocsonyás anyag gyulladása (üvegtestgyulladás),
- a szem elülső részének gyulladása (elülsőcsarnok-gyulladás vagy "flare"),
- a szivárványhártya és a szemben lévő szomszédos szövetek gyulladása (iridociklitisz),
- a szemgolyó átlátszó rétegének, a szaruhártyának a vizenyője (szaruhártya-ödéma),
- vérzés a szemben (üvegtesti vérzés),
- hirtelen látásvesztés a szem hátsó részén lévő erek elzáródása miatt (retinális érelzáródás),
- szem hátsó részén lévő erek gyulladása (retinális érgyulladás).
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti a https://mellekhatas.ogyei.gov.hu/ weboldalon. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Beovu-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A dobozon és a címkén feltüntetett lejárati idő (EXP) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 °C - 8 °C) tárolandó.
Nem fagyasztható!
A fénytől való védelem érdekében az előretöltött fecskendőt tartsa a leforrasztott buborékcsomagolásban és a kartondobozban.
Az alkalmazás előtt az előretöltött fecskendőt tartalmazó bontatlan buborékcsomagolás legfeljebb 24 órán keresztül szobahőmérsékleten (legfeljebb 25 °C-on) tartható.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Beovu?
- A hatóanyag a brolucizumab. Az oldatos injekció milliliterenként 120 mg brolucizumabot tartalmaz. Minden előretöltött fecskendő 19,8 mg brolucizumabot tartalmaz 0,165 ml oldatban. Ez biztosítja azt a felhasználható mennyiséget, ami egyetlen adag 6 mg brolucizumabot tartalmazó, 0,05 ml-es oldathoz szükséges.
- Egyéb összetevők: nátrium-citrát, szacharóz, poliszorbát 80, injekcióhoz való víz.
Milyen a Beovu külleme és mit tartalmaz a csomagolás?
A Beovu 120 mg/ml oldatos injekció előretöltött fecskendőben (injekció) tiszta vagy kismértékben opálos, színtelen vagy enyhén barnássárga vizes oldat.
1 előretöltött fecskendőt tartalmazó csomagolás, kizárólag egyszeri felhasználásra.
A szöveg publikálásának dátuma az ema.europa.eu weboldalon: 2023.04.11.
